人生の早期に獲得されるがん遺伝子変異、がんに進展する細胞・しない細胞の違いは?
京都大学は7月28日、乳がんについて、思春期前後に生じた最初の変異の獲得から数十年後の発症にいたるまでの全経過を、最先端のゲノム解析技術を駆使することによって、世界で初めて明らかにすることに成功したと発表した。この研究は、同大医学研究科の小川誠司教授、戸井雅和教授(現:東京都立駒込病院長)、西村友美特定助教、白眉センターの垣内伸之特定准教授、東京医科歯科大学の宮野悟特任教授、慶應義塾大学の佐藤俊朗教授らの研究グループによるもの。研究成果は、「Nature」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
乳がんは日本人女性において最も頻度の高いがんであり、2019年の罹患者数は10万9,000人以上にも及ぶ。罹患数、死亡数ともに年々増加傾向にあり、40~50代と若年での発症が多いことからも、社会的重要性の高い疾患である。近年、乳がんを含むさまざまながんについてがんが発生するメカニズムを遺伝学的な観点から解明しようとする試みが盛んに行われているが、発がん過程のごく初期にどのような変化が起こるのかはよくわかっていなかった。
がんの多くは生存・増殖に有利なゲノムの変化(ドライバー変異)を獲得した細胞が異常に増殖することで発症すると考えられている。しかし、がんそのもののゲノム解析からだけでは、ドライバー変異がいつ、どの順番で獲得され、進化のどの段階で細胞ががん化するのかを知ることはできなかった。近年、発がん過程のごく早期に生ずるゲノムの変化を調べるために正常組織のゲノム解析が行われるようになると、一見正常に見える組織にもすでにがんで認められるのと同様な遺伝子変異が生じていることがわかってきた。すなわち、さまざまな組織・臓器において、一見正常に見えても、すでにがん遺伝子の変異を獲得した細胞の集団(クローン)が多数生じていることが明らかになってきた。また、こうした遺伝子の変異は人生の極めて早期から獲得されることもわかってきた。
これらの遺伝子変異の多くはがんで認められる変異と同じであるため、そうした多数のクローンの中からがんが発生するのではないかと考えられるが、では、一体なぜ、ヒトが生涯に発症するがんは高々一つか二つで、他の大多数のクローンはがんにならないのか、また、変異を持った細胞が人生の早期に現れるとすれば、どのような経過でそれらががんにまで進展するのか。これらの疑問に答えるためには、がんとがんに進展しなかった細胞を同時に解析することが必要となる。
加齢・閉経・出産・ドライバー変異獲得などにより遺伝子変異の蓄積数が変化
今回、研究グループは、がんと周囲の一見正常に見える組織を最新の技術を用いて詳細に解析することによって、がんの進化の歴史を詳細に辿り、正常な乳腺上皮がいつ、どのような順番でドライバー変異を獲得し、どのような遺伝学的・形態学的変化を経て乳がんが発生するに至ったかを世界で初めて明らかにすることに成功した。
研究グループはまず、加齢に伴って正常な乳腺の細胞にどのように遺伝子変異が蓄積するのかを知るために、さまざまな年齢の乳がん患者の乳腺組織や授乳中の女性の乳汁から乳腺の細胞を集めて培養し、次世代シーケンサーを用いて一つの細胞に蓄積した遺伝子変異を調べた。その結果、1)乳腺の細胞にも加齢に従って遺伝子変異が蓄積すること、2)遺伝子変異が蓄積する速度は閉経を契機に緩やかになること(閉経前は1年ごとに+19.5変異、閉経後は1年ごとに+8.1変異)、3)出産を経験した女性では遺伝子変異の数は減少すること(1回出産するごとに-54.8変異)4)ドライバー変異を獲得した細胞では遺伝子変異の数は増加すること(+210.4変異)が明らかになった。
エストロゲンの増減を伴う女性のライフイベントが影響を与える
女性ホルモンの一つであるエストロゲンは細胞のゲノムに傷をつけたり、細胞の分裂を促進したりすることによって遺伝子変異の蓄積に関与する可能性が示唆されていたが、エストロゲンの量が低下する閉経にともなって、乳腺における遺伝子変異の蓄積速度が大きく減少するという今回の観察結果は、そうした従来の実験結果を支持する結果だった。一方、出産を経験することで遺伝子変異の数が見かけ上大きく減少することは、予想に反する結果だった。細胞にいったん生じた数十個もの変異が元に戻ることはなく、妊娠期間の10か月の間はエストロゲンの量はむしろ顕著に上昇するため、この観察結果は出産後の授乳期間のエストロゲンの量の低下では説明できない。むしろ、妊娠・出産に伴う変異数の低下は、乳腺の細胞が変異を蓄積していない細胞に置き換わる可能性を示唆している。妊娠・出産・授乳期間を通じて、乳腺は授乳の要求を満たすために著しい増殖を示すが、この期間が終わると急速に縮小する。この際に、増殖した細胞はプロラクチンなどのホルモンの支持を失って急速に細胞死に陥ると考えられるが、その後乳腺の再構築には、それまで細胞の分裂を繰り返すことなく休眠していた幹細胞によって新たに再構築されると推測された。このように、乳腺における遺伝子変異の蓄積には、加齢だけではなく、エストロゲンの増減を伴う女性特有のライフイベントが影響を与えていることが明らかになった。初経、妊娠、出産、授乳、閉経などのライフイベントが乳がんの発症リスクに影響を与えることは以前から知られており、今回の研究結果はエストロゲンに関連した発がんメカニズムを紐解く一助となることが期待される。
患者5人の乳腺組織、正常な乳腺上皮にも近傍のがんと同じドライバー変異
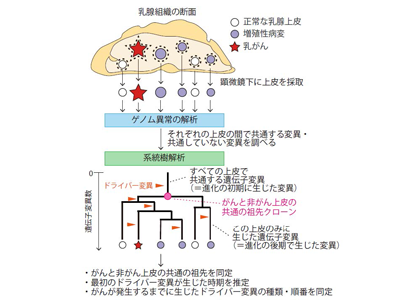
次に、乳がんの進化の歴史を解明するために、周囲に良性の増殖性病変を複数伴っている乳がんを選び、手術で切除された乳腺組織から乳がんと増殖性病変や正常な乳腺上皮を顕微鏡下に細かく分けて採取し、次世代シーケンサーを用いてそれぞれのゲノムの異常を調べた。エストロゲンにより増殖が促進されるホルモン感受性乳がんをもつ閉経前の患者5人の乳腺組織を調べたところ、ほとんどの増殖性病変と正常な乳腺上皮の一部にも近傍のがんと同じドライバー変異が確認され、これらの非がん上皮とがんは同一のドライバー獲得非がんクローンから発生したことがわかった。
思春期前後にder(1;16)転座発生、増殖・拡大しながら数十年かけて乳がん発症
同じクローンから発生した非がん上皮とがん、両者のゲノム異常の類似点・相違点を探して進化の系統樹を再構築し、個々の上皮におけるドライバー変異の有無を詳細に調べることで、この非がんクローンがどのような遺伝学的・形態学的変化を経て乳がんの発生に至ったかを調べた。この結果、1)がんではないクローンにおいても、がんで認められるのと同一の染色体異常der(1;16)転座(1番染色体と16番染色体の間の異常な再構成で形成された派生染色体)がしばしば認められる(6/7クローン)、2)この染色体異常は、がんとがんではないクローンの共通の祖先の細胞に思春期前後に生じたと推定される、3)最初にder(1;16)を獲得してから乳がんの発症に至るまでには数十年の年月を要すること、4)その間に、この染色体異常を獲得した非がんクローンは、周囲の上皮を置き換えるようにして乳腺組織の中を数2.5cmから8.5cmにわたって増殖・拡大する一方、乳腺の各所で独自の進化を遂げ、さまざまなドライバー変異を追加で獲得しながら、正常な上皮から増殖性病変、がんにいたるまで多彩な形態の上皮を形成したこと、5)der(1;16)を獲得して拡大したクローンの中から、複数のがんがさまざまな時間経過で生じていること、が明らかになった。
最初のドライバー変異獲得から乳がん発生に至る進化の歴史、順を追って説明可能に
der(1;16)転座は乳がん全体の約20%に認められる頻度の高い異常であるが、上記の変化は、このder(1;16)転座を有する乳がんで共通に認められる特徴であると考えられた。der(1;16)陽性乳がんの90%以上はホルモン感受性であること、閉経後に発症したder(1;16)陽性乳がんでは周囲に非がんクローンの拡大をほとんど伴っていないことから、der(1;16)獲得非がんクローンの増殖・拡大・進化はエストロゲンにより促進され、閉経時にがん化に至っていなかった上皮はその後のエストロゲンの急激な減少によって消退するものと考えられた。このように、乳がんの発生に至るまでの進化の歴史を最初のドライバー変異獲得から順を追って解明できたことにより、der(1;16)陽性乳がんの特徴的な発がんメカニズムの一端を明らかにすることができた。
他のタイプの乳がん発症メカニズム解明にも応用可能な手法
乳がんの約70%はホルモン感受性であり、初経、妊娠、出産、授乳、閉経などエストロゲンの増減を伴う女性特有のライフイベントが乳がんの発症リスクに影響を与えることは広く知られているが、そのメカニズムについてはまだよくわかっていない。今回の研究では、乳腺の上皮における遺伝子変異の蓄積にエストロゲンが影響を与えることが明らかになり、発がんの初期段階でエストロゲンが果たす役割を解明する一助となることが期待される。また、今回、乳がんの約20%を占めるder(1;16)陽性乳がんについて、発がんの初期段階からの遺伝学的・形態学的な進化の歴史が明らかになり、der(1;16)が生じた細胞からの発がんにエストロゲンが重要な役割を果たす可能性が示唆された。思春期にder(1;16)を獲得しながらも、閉経を契機にクローンが消退し発がんには至らない女性が一定数存在している可能性があり、がんに進展するクローンと消退するクローンの違いを規定する因子の探索が今後の課題となる。これが明らかになれば、der(1;16)獲得非がんクローンの拡大が認められた女性における発がんリスク予測や効率的な検診、発がん予防のためのよりよい方策の開発につながることが期待される。
「今回の研究ではがんとがんの周りの良性の上皮を丹念に調べることで、今まで明らかになってこなかった発がんの初期段階の変化を捉えることができた。この手法を他のタイプの乳がんにも応用することで、残り80%の乳がんの発がんメカニズムの解明も試みていく」と、研究グループは述べている。
▼関連リンク
・京都大学 最新の研究成果を知る




