有糸分裂後にミスフォールディングタンパク質を分解するシステムは未解明
東京大学医科学研究所は7月21日、神経細胞内の異常タンパク質凝集の分解を誘導する新たな酵素を同定したと発表した。この研究は、同研究所癌防御シグナル分野の李丹特任研究員(現 ハーバード大学研究員)、中西真教授、同大学大学院医学系研究科の戸田達史教授、金沢大学がん進展制御研究所の城村由和教授研究所らの研究グループによるもの。研究成果は、「Nature Aging」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
多くの加齢性疾患はタンパク質のミスフォールディングと関連しており、またある種の環境ストレスは成熟タンパク質のミスフォールディングを誘発する。これを回避するために、細胞は翻訳制御、分子シャペロン活性、プロテアソームやオートファジーによるタンパク質分解などのタンパク質品質管理(PQC)システムを備えている。多くの神経変性疾患に共通する特徴は、ミスフォールドタンパク質の蓄積であることから、これら疾患の神経細胞ではPQCシステムの破綻が予想される。とりわけ、ミスフォールドタンパク質を選択的に分解する機構は神経変性疾患発症に重要と考えられているが、有糸分裂後の細胞で主に機能するシステムについてはほとんど理解されていない。
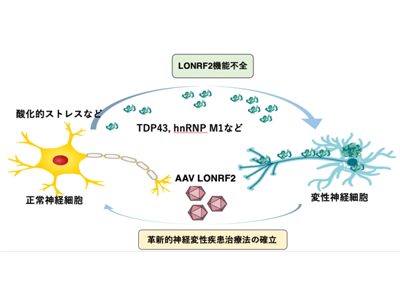
見出されたLONRF2、変性したhnRNP M1/TDP-43をユビキチン化
研究グループは、有糸分裂から有糸分裂後へのスイッチのモデルとして老化細胞を用い、Lonrf2遺伝子の発現が老化誘導後に誘導されることを見出した。LONRFファミリーはRINGフィンガードメインを持つユビキチン化酵素で、LONRF1-3から構成されているが、その酵素的、生理的機能、病態における役割は未解明だった。LONRF2は主に細胞質と核に存在し、老化細胞に過剰発現させると細胞内のタンパク質凝集体が減少し、発現抑制すると凝集体が増加する。
個体内においては、Lonrf2は神経細胞で主に発現している。老化したマウスの脳から得られたデータセットの単一細胞解析では、Lonrf2は主に成熟神経細胞で発現していた。TDP-43やhnRNP M1を含む神経細胞内のミスフォールディングタンパク質は、ALSやFTLD2のような多くの神経変性疾患と関連している。野生型LONRF2は、A549細胞においてタンパク質変性下でのみhnRNP M1とTDP-43の両方をユビキチン化した。またこの活性はLonSBやRINGドメインを欠失した変異体では見られなかった。
Lonrf2ノックアウトマウス、運動学習障害や短い寿命を示す
次にLonrf2ノックアウトマウス(Lonrf2-/-)を作製し、解析を行った。Lonrf2-/-マウスは、正常なメンデル比で明らかな発育異常なしに生まれ、体重は野生型同腹子と同じで、18か月齢まで正常に見えた。しかしながら、Lonrf2-/-マウスは雌雄ともに21か月齢までに野生型と比較して年齢依存性の握力の低下や、ロータロッド試験での運動学習障害などの運動障害を発症し、短い寿命を示した。
ALS患者と同様の筋萎縮・神経筋接合部欠損も示す
脊髄の免疫組織化学的解析から、Lonrf2-/-マウスのコリンアセチルトランスフェラーゼ陽性神経細胞の数は、生後21か月では野生型と比較して有意に減少していた。またTDP43凝集体陽性の神経細胞数も増加していた。筋萎縮と神経筋接合部の欠損はALS患者の典型的な特徴の一つである。Lonrf2-/-マウスの筋線維径の分布は、野生型と比較して小径にシフトしており、脱神経したアセチルコリン受容体クラスターの数が増加していた。
これらの結果は、Lonrf2-/-マウスが運動神経変性や、筋萎縮と神経筋接合部欠損を示しており、LONRF2が生体内でTDP-43のようなミスフォールディングタンパク質を分解することを示唆している。
ALS由来運動神経細胞に起こる神経突起の短小化、Lonrf2発現で改善
運動神経に見られる異常は、Lonrf2-/-マウス由来のiPS細胞を運動神経に分化させても観察され、Lonrf2を発現させると回復した。重要なことに、ALS患者由来のiPS細胞を運動神経細胞に分化させると正常に比較して神経突起の短小化を認めるが、この異常もLonrf2を発現することで改善した。最後に、特発性ALS患者においてLONRF2のミスフォールドタンパク質をユビキチン化する活性を喪失したバリアント遺伝子を同定した。
「今回の研究結果は、LONRF2がALSなどの神経変性疾患の発症に関わっている可能性を示唆しており、今後LONRF2を用いた全く新しい革新的な神経変性疾患治療法に有用であると考えられる」と、研究グループは述べている。
▼関連リンク
・東京大学医科学研究所 プレスリリース




