膀胱への刺激が低く、継続使用できる治療薬の開発へ
大阪大学は7月19日、筋層非浸潤性膀胱がん(NMIBC)に対して行う経尿道的膀胱切除術(TURBT)でがん組織を切除後、再発抑制のために亜塩素酸ナトリウム(開発コード:HM-001)を膀胱内に注入する治療法の確立を目指し、安全性と有効性を確認するための医師主導治験を、同大医学部附属病院で開始したと発表した。この治験は、同大大学院医学系研究科泌尿器科学の河嶋厚成講師が計画し、同大発のベンチャー企業である株式会社HOISTが開発した治験薬を用いて行われる。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
膀胱がんは男性に多く発症し、新たに診断された膀胱がんの約70%がNMIBCである。NMIBCに対する治療は、膀胱温存を目指して、TURBTを行う。NMIBCの臨床的特徴は、TURBTによる治療後も高率かつ頻回に膀胱内再発を認めることであり、これは膀胱内の残存腫瘍によるものだ。NMIBC治療では、TURBT後に薬剤を膀胱内に注入することで膀胱がんの再発・進展を抑制することが非常に重要とされている。しかし、膀胱がん診療ガイドラインで推奨されているTURBT後のBCGや抗がん剤の膀胱内注入療法では、膀胱内刺激が強いことから治療継続率は高くなく、非再発率も50~80%程度にとどまっている。
阪大発ベンチャーHOISTが治験薬を製造
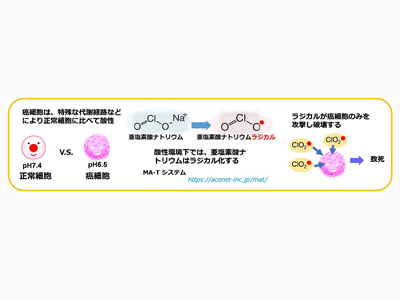
これまでに、同大大学院薬学研究科細胞生理学分野の辻川和丈教授らの研究グループは、細胞および動物を用いた試験において、亜塩素酸ナトリウムが膀胱がん細胞の増殖を抑制することを明らかにしている。この成果をHOISTが引き継ぎ、動物試験での更なる有効性の確認、GLP基準に基づいた安全性の確認、治験薬の製造を行っている。今回使用する治験薬は、HOISTがGMP基準に準拠して製造し、提供する。同社は、「MA-T(TM)システム」(亜塩素酸イオンから必要な時に、必要な量の水性ラジカルを発生させる酸化制御技術)を活用した医薬品の実用化を目指している。
NMIBC患者が対象、第Ⅰ相試験は最大18人登録予定
治験は第Ⅰ/Ⅱa相臨床試験。第Ⅰ相試験(パート1)では、NMIBC患者を対象にHM-001の3つの薬剤用量を設定し、低い薬剤用量から3例ずつTURBTの1週後に膀胱内へ1回注入し、4週の間隔を空けた後から週1回の膀胱内注入を6週継続する。3例毎にHM-001の安全性を第三者委員会で評価し、安全であると判断された場合には、1つ上の用量で3例の患者さんの膀胱内に注入する。治験薬に起因し、安全性に懸念が生じた場合には同じ用量で3例を追加して安全性を再度評価する。安全であると判断された場合には1つ上の用量に移る。この手順を繰り返し、3つの薬剤用量の安全性を評価し、将来の治療で用いる薬剤用量(推奨用量)を決定する。
第Ⅱa相試験(パート2)では、NMIBC患者を対象に、パート1で推定された推奨用量・パート1と同じスケジュールで導入治療を行い、その後、維持治療として週1回3週間連続での膀胱内注入を13週間隔で3回繰り返し、TURBTから57週後(約1年後)の膀胱がんの非再発率を有効性指標として評価し、また、有害事象の発現状況などの安全性の評価を行う。登録患者は、パート1で最大18人、パート2で30人を予定している。
研究グループは、「TURBT後にHM-001を膀胱内に注入して膀胱内の刺激が弱いことが明らかになれば、従来の治療法に比べて治療継続率が高まり、更には膀胱がんの非再発率が高まることで、患者の予後およびQOL改善につながることが期待される」と、述べている。
▼関連リンク
・大阪大学大学院医学系研究科 NEWS & TOPICS




