日本で比較的頻度が高いXP、エキソーム解析では原因が特定できない症例も
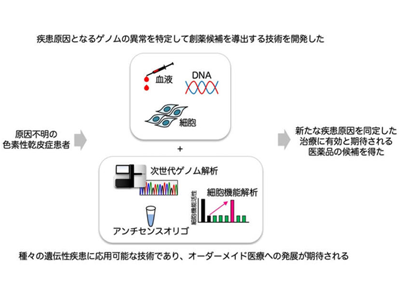
名古屋大学は6月27日、日本人に高頻度にみられる遺伝性皮膚疾患である、色素性乾皮症(XP)の原因となる遺伝子の異常と、この遺伝子異常を有する患者(日本国内におよそ500人ほど)の治療に有効であることが期待される医薬品の候補を新たに同定したと発表した。この研究は、同大環境医学研究所の千住千佳子大学院生、中沢由華講師、尾曽太一大学院生、荻朋男教授、神戸大学の錦織千佳子特命教授、大阪医科薬科大学の森脇真一教授、熊本大学、長崎大学らの研究グループによるもの。研究成果は、「The Proceedings of the National Academy of Sciences(PNAS)」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
色素性乾皮症(xeroderma pigmentosum:XP)は、日光過敏や皮膚がんを高頻度に発症する遺伝性の皮膚疾患であり、病気の発症原因は不明で有効な治療法がなく、患者数の少ない難病に属している。日本では海外に比べると10倍ほど多くXPの患者がみられ、有病率は2万5,000人に1人程度と、遺伝性疾患の中では比較的頻度が高い病気である。
XPは、日光に含まれる紫外線によってできたDNAの傷を修復する生体防御システムが機能しなくなることで発症する。遺伝情報が格納されているゲノムDNAには、常にさまざまな損傷が生じているが、生じた損傷の種類に対応したDNA修復機構が適切に機能することで、損傷を取り除き、ゲノムを安定に維持している。このDNA修復機構に異常があると、生じたDNA損傷を修復できず、遺伝情報の適切な利用や、遺伝情報の正確な伝達・維持ができなくなる。このようなDNA修復機構に異常を示す疾患は総称して「ゲノム不安定性疾患群」と呼ばれ、XPもその一つである。
現在、NGSと呼ばれる技術を用いて、世界中でさまざまな遺伝子解析が行われている。NGSの中でも、遺伝性疾患の原因特定に最もよく用いられる技術が、「エキソーム解析」で、タンパク質を作るのに必要な遺伝情報が記録されている、一部(全体のおよそ1%)のDNA配列情報を取得するというものである。しかし、この「エキソーム解析」では、疾患原因が特定できない症例が多数出てきたことから、近年では、全ての遺伝情報を取得する「全ゲノム解析」法も取り入れられるようになってきた。
全ゲノム解析によりXPF遺伝子イントロン領域の配列異常を発見
研究グループは、臨床的にXPが疑われ「エキソーム解析」を実施したものの、疾患原因が不明であった日本人症例について、「全ゲノム解析」を活用し、その疾患原因となる遺伝子異常の特定に取り組んだ。また、配列情報の取得とあわせて患者由来の細胞を用いたDNA修復活性検査を実施した。
その結果、「エキソーム解析」では検出不可能な、XPF遺伝子のイントロン領域の配列異常により、疾患を発症していることがわかった。メッセンジャーRNAを転写する過程では、タンパク質を作るのに必要な情報であるエキソン領域のみを抜き出し、イントロン領域を取り除くスプライシング処理を行うが、今回見つかった遺伝子の異常を持つ患者は、XPF遺伝子のスプライシングが正常に行われないためXPFタンパク質が作られず、紫外線によってできたDNAの傷を取り除くヌクレオチド除去修復機構が機能しないため、XPを発症していることがわかった。
誤ったスプライシングを阻害するASO、DNA修復活性を回復
次に研究グループは、患者の細胞内で正常なスプライシング反応を行えるようにすることで、XPの病状緩和や治療が可能になるのではないかと考えた。今回確認された異常は、スプライシング反応を行う因子が、XPF遺伝子mRNAイントロン領域内の誤った配列に結合することで発生する。スプライシング因子が誤った配列に結合するのを阻害することで、正常な位置でスプライシング反応を起こすことが可能になる。そこで、mRNAに結合する短い核酸(アンチセンスオリゴヌクレオチド:ASO)を利用することを検討した。患者に特異的なイントロン内のmRNA配列にASOが結合することで、誤ったスプライシングが起きないようにできるのではないかと考えた。実験の結果、ASOを作用させた患者由来細胞では、正しい位置でスプライシングが起き、XPFタンパク質が作られるようになり、また、DNA修復活性も回復することが確認された。この結果は、ASOが今回のXP症例の有効な治療薬の候補になることを示している。
疾患原因となるmRNA上の異常配列をASOによりブロックすることで、タンパク質発現と細胞機能(DNA修復活性など)を回復させる手法は、他のさまざまな疾患にも応用が可能である。
ASOでのmRNA配列ブロック、原因配列特定と治療薬候補の選出を同時実現の可能性
全ゲノム解析では、疾患原因となる遺伝子の異常のほかにも、多くの配列上の差違が検出されるため、その中から本当の疾患原因を特定することが必要になるが、実はこれはとても大変な作業である。特に今回のような、タンパク質に翻訳されないイントロン領域の異常は、それが本当に疾患の原因かどうかを判定することは非常に困難である。近年、AIを活用した解析技術を取り入れるなどさまざまな試みがなされているが、イントロン領域の疾患原因の特定は、なかなか進んでいない。
今回、研究グループが実施したASOによるによる異常なmRNA配列のブロック法は、真の疾患原因変異をブロックした場合にのみタンパク質発現と細胞機能の回復が見られることから、この方法を用いると、疾患原因となる配列異常の特定(ブロックした配列が疾患原因である)と、治療薬候補の選出(ブロックに用いたASOがそのまま医薬品の候補となる)が同時に実現可能となる。「また本法は、XPに限らず全ての遺伝性疾患に応用が可能である。将来的には、さまざまな希少疾患のオーダーメイド医療への発展が期待される技術である」と、研究グループは述べている。
▼関連リンク
・名古屋大学 研究成果発信サイト




