PSC、現状では肝移植以外に有効な治療法がない
慶應義塾大学は6月27日、肝移植以外に有効な治療法が少ない難治性自己免疫性疾患である原発性硬化性胆管炎(PSC)患者の腸内細菌を解析し、病気を引き起こす仕組みを明らかにしたと発表した。この研究は、同大医学部内科学教室(消化器)の中本伸宏准教授、金井隆典教授らの研究グループによるもの。研究成果は「Nature Communications」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
PSCは、肝臓内外に存在する胆汁の流れ道である胆管に炎症がおき、数年から数十年の経過により胆管狭窄に伴って胆汁が滞り、肝硬変へ進展することが多い原因不明の自己免疫性疾患である。国内における推計患者数は約2,300人であり今後患者数の増加が予想され、国の難病特定疾患に認定されている。
病因として多くの遺伝的要因、環境的要因の関与が報告されているが、病態の解明には至っておらず、肝移植以外に有効な治療法が存在しないのが現状だ。PSCは高率に潰瘍性大腸炎やクローン病などの炎症性腸疾患(IBD)を合併することを特徴とし、腸管炎症に伴う腸管バリアの低下により腸内細菌やその代謝産物が胆管や血管を通じて肝臓に到達し、病態の発症や進展に関わっていると考えられてきた。研究グループは、PSC患者の便中に肝臓内のインターロイキン17 (IL-17)を産生するCD4 陽性のヘルパーT細胞TH17細胞の活性化を引き起こす3種類の腸内細菌が存在することを発見し、2019年に国際学術誌に報告した。しかし、これらの腸内細菌を治療標的とした実臨床への応用性については明らかになっていなかった。
PSC患者便に高率に検出されたクレブシエラ菌が治療標的
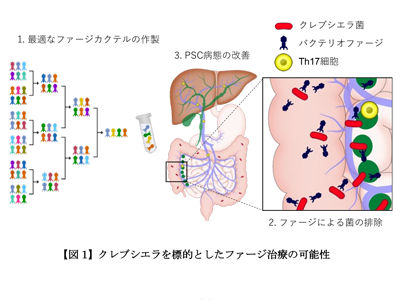
研究では、IBDを合併していない患者11人、IBDを合併している患者34人、合計45人のPSC患者便の腸内細菌を解析し、臨床像との関係性を調べた。その結果、IBDの有無や大腸の炎症の部位に関わらず、PSC患者便にクレブシエラ菌(Kp)とエンテロコッカス菌(Eg)の2菌が高率に検出されることを確認した。
さらに、患者から分離したクレブシエラ菌を、肝臓に炎症を起こした肝臓線維化モデルマウスに投与し、フローサイトメトリーを用いた解析を行った。その結果、肝臓内のTH17細胞が増加し、肝硬変の程度が悪化することからクレブシエラ菌がPSCの治療標的となることが考えられた。
クレブシエラ菌の増殖を長期間抑制し続けるファージカクテル作製に成功
細菌の増殖を抑制し殺菌する手段として抗菌薬が日常診療で広く用いられているが、長期間の使用による多剤耐性菌の出現や院内感染が大きな問題となっている。そこで研究グループはこの問題を打破するために、特定の病原細菌のみを選択的に殺菌可能であり、耐性菌の出現頻度が低いバクテリオファージの作製に着手した。イスラエルのBiomX社との共同研究のもと、自然環境に存在するクレブシエラ菌を標的とするファージを複数組み合わせることにより、培養液中のクレブシエラ菌の増殖を長期間抑制し続けるファージカクテルの作製に成功した。
次に、クレブシエラ菌を腸内に定着させたマウスにこのファージカクテルを週2回合計4回投与し、その体内での菌の増植の抑制効果の有無を14日目に検討した。その結果、便中のクレブシエラ菌はファージの投与後その数が劇的に減少することが示され、この効果が28日目まで持続することを確認した。
ファージ投与により肝線維化モデルマウスの肝硬変の程度が改善
最後に、臨床応用を考え、クレブシエラ菌を投与した肝線維化モデルマウスにファージカクテルを投与し、肝硬変の改善効果の有無を検討した。同様に週2回の投与により、クレブシエラ菌によって誘導された肝臓内TH17細胞の数は減少し、その結果胆管の炎症マーカーである血清ALP値が低下し、肝硬変(線維化)の程度も50%程度に改善した。以上の結果から、クレブシエラ菌を選択的に排除するファージ療法が、PSCに対して有効である可能性が示された。
クレブシエラ菌を標的としたファージ治療による臨床応用に期待
現在、世界中でPSCに対して胆汁酸、核内受容体リガンド、抗線維化薬などさまざまな新薬の臨床試験が行われているが、いまだ長期的な改善効果を示す治療法は報告されていない。今回の研究では、クレブシエラ菌がこの病気の病態に関係する診断のバイオマーカー、さらには治療標的となることが初めて示され、クレブシエラ菌を選択的に排除するファージカクテルの投与によりマウスの肝硬変の程度が改善することも初めて示された。「今後、国内外の多くの患者の解析を行うと共に、複数のクレブシエラ菌を網羅的に排除する新たなファージカクテルを用いた治療効果や安全性の検証により、臨床応用につながることが期待される」と、研究グループは述べている。
▼関連リンク
・慶應義塾大学 プレスリリース




