腎臓のどの部位で肥大が起きるのかは不明だった
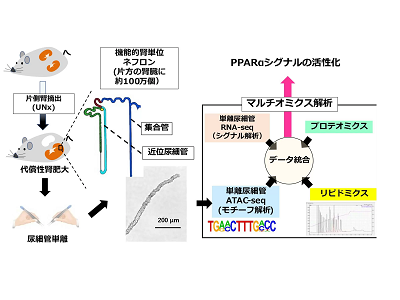
東京医科歯科大学は6月16日、代償性腎肥大の原因となるシグナルを、単離尿細管を用いたRNA-seq、ATAC-seq、腎臓を用いたプロテオミクス、リピドミクスによるマルチオミクス解析によりつきとめたことを発表した。この研究は、同大大学院医歯学総合研究科、茨城県腎臓疾患地域医療学講座の菊池寛昭助教の研究グループと、米国国立衛生研究所(NIH)の共同研究によるもの。研究成果は、「Nature Communications」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
腎臓は血中の老廃物や余分な水分、塩分を濾過し尿を生成する臓器であり、その機能単位はネフロンと呼ばれる。ネフロンは少なくとも14種類の尿細管上皮細胞によって構成されており、部位特異的なシグナル解析が非常に難しい臓器である。腎臓がんなどの病気の治療のために腎臓の一部を切除すると、失われた機能を補うために残った腎臓が大きくなることが知られている。しかし、どのようなメカニズムで腎臓の肥大が起きるのか、腎臓のどの部位で肥大が起きるのかなどは明らかにされていない。これまでに、残った腎臓にアミノ酸の負荷がかかることによって引き起こされるmTORシグナルの活性化等が主に報告されてきたが、それだけでは肥大化の説明することはできない。
研究グループは、尿細管単離の技術を用いて、まず代償性肥大が起きやすい尿細管の部位を特定し、次に網羅的解析を用いて腎肥大が起きるメカニズムを「unbiased(仮説フリー)」に同定することを目指した。
近位尿細管では細胞肥大が、皮質集合管では細胞増殖が主たる現象と判明、モデルマウスで
マウス片側腎摘出モデル(UNx)を用いて、代償性腎肥大のメカニズムの探求を行った。腎重量/ 体重 インデックスを用いた検証から、UNx後24時間の時点では代償性腎肥大が活発であり、UNx後72時間の時点では代償性腎肥大が止まっていることを確認した。また、肥大した腎臓から尿細管を単離し、代償性肥大が起きている尿細管は主に近位尿細管と皮質集合管であることを突き止めた。蛍光顕微鏡と画像解析ソフト(IMARIS)を用いた観察から、近位尿細管では細胞肥大が主たる現象であるのに対し、皮質集合管では細胞増殖が主たる現象であることを発見した。
単離した近位尿細管で、PPARαが標的とするタンパク質の発現上昇
次に、研究グループは単離した近位尿細管を用いてRNA-seqを施行し、肥大した近位尿細管では、脂質代謝のマスターレギュレーターであるペルオキシソーム増殖剤応答性受容体α(PPARα)が標的とする遺伝子の発現が上昇することを発見した。また、プロテオミクスを用いた解析でも同様に、PPARαが標的とするタンパクの発現上昇を認めた。さらに、研究グループは、単離尿細管を用いたクロマチンアクセシビリティ解析(ATAC-seq)の開発に着手し、PPARαの結合モチーフをもつゲノム領域が、より肥大した近位尿細管においてアクセシビリティが高くなっていることを発見した。
PPARα活性化が代償性尿細管肥大の原因と判明
PPARαは、肝臓、腎臓、筋肉など脂肪酸異化活性の高い組織で高発現している、DNAに結合するリガンド依存的な転写調節因子、核内受容体であり、PPARα のリガンドとなる生体内分子としては、炭素数14から20の飽和および不飽和脂肪酸が考えられている。研究グループは、ガスクロマトグラフィー質量分析法(GC/MS)を用いた解析から、肥大した腎臓においてこれらの脂肪酸がより多く認められることを明らかにした。最後に、PPARαのノックアウトマウスを用いた検証から、PPARαの活性化が代償性尿細管肥大の原因となっていることを明らかにした。
代償性尿細管肥大のメカニズム解明が腎不全治療となることに期待
日本における慢性腎不全(CKD)患者数は1330万人と推計され、維持透析患者数は33万人にのぼる。腎障害の進行は透析や腎移植といった腎代替療法を要するだけでなく、心血管合併症を引き起こすことから患者のQOLや医療費削減の点で非常に重要な課題だ。CKDの原因疾患はさまざまだが、現行治療は一様な保存的加療が中心であり、CKDの個々の病態に直接アプローチする治療法の開発が必要だ。「CKDの原因疾患として糖尿病、高血圧が半数以上を占め、これらの疾患では、腎臓の機能的単位であるネフロンに過剰濾過が生じ、尿細管肥大を来すことが知られている。代償性尿細管肥大のメカニズムの解明が腎不全の治療につながることが期待される」と、研究グループは述べている。
▼関連リンク
・東京医科歯科大学 プレスリリース



