NAFLD/NASH等に起因する肝細胞がん、予後予測因子や発症メカニズムの詳細は未解明
東京医科歯科大学は6月13日、非ウイルス性肝細胞がんの特異的予後予測因子としてミトコンドリア内膜トランスポーターSFXN1を同定し、SFXN1の不活性化が脂肪負荷時における脂肪の取り込み・活性酸素種(ROS)の産生を抑制して、脂肪毒性(lipotoxicity)を軽減し、生体内の脂肪負荷耐性に寄与することを明らかにしたと発表した。この研究は、同大大学院医歯学総合研究科分子腫瘍医学分野の田中真二教授、島田周助教、秋山好光講師、波多野恵助教、八木宏平大学院生、同肝胆膵外科学分野の田邉稔教授らの研究グループによるもの。研究成果は、「Scientific Reports」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
肝細胞がんはB型肝炎ウイルスやC型肝炎ウイルスの感染、アルコール多飲、メタボリックシンドロームなどさまざまな病因を背景とする複雑な疾患である。B型肝炎ウイルスワクチンの普及とC型肝炎ウイルス治療薬の開発によりウイルス性肝細胞がんは減少してきているが、糖尿病や肥満などのメタボリックシンドローム、非アルコール性脂肪性肝疾患(NAFLD)や非アルコール性脂肪性肝炎(NASH)を原因とする非ウイルス性肝細胞がんはむしろ増加傾向となっている。しかし、非ウイルス性肝細胞がんの予後予測因子は報告されておらず、発症メカニズムもその詳細は解明されていない。
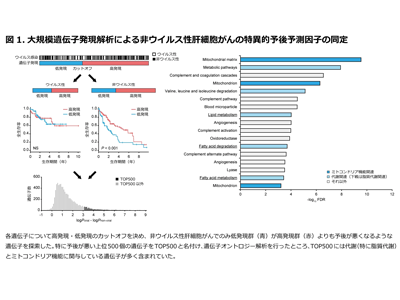
患者370人の遺伝子発現を解析、予後と相関が強い上位500個はミトコンドリア機能に関与
研究グループはThe Cancer Genome Atlas Research Network(TCGA)から提供されている遺伝子発現公開データベースを用いて、非ウイルス性肝細胞がん患者の予後と相関し、腫瘍部分で発現低下している遺伝子を探索し、非ウイルス性肝細胞がん発症における役割を解析した。
TCGAデータを用いて、370人の肝細胞がん患者(ウイルス性153人、非ウイルス性217人)の2万531個の遺伝子について大規模遺伝子発現解析を行った。非ウイルス性肝細胞がんにおいてのみ発現低下群が予後不良となるような8,190個の遺伝子を抽出し、予後との相関が強い上位500個の遺伝子をTOP500と名付けた。遺伝子オントロジー解析を行ったところ、TOP500は脂質代謝とミトコンドリア機能に関与していることを見出した。
SFXN1低発現群、非ウイルス性肝細胞がんにおいて無再発生存率・全生存率が悪い
そこで、TOP500に含まれるミトコンドリア内膜関連遺伝子の中で最も予後との相関が強い遺伝子SFXN1に注目した。
同大で切除された肝細胞がん組織検体105症例について免疫染色を行ったところ、33症例においてSFXN1タンパク質の発現低下が認められた。全肝細胞がん症例において、SFXN1低発現群はSFXN1高発現群と比較して無再発生存率(P=0.025)と全生存率(P=0.033)が悪いことがわかった。サブ解析によりウイルス性肝細胞がんではこのような傾向は認められなかったが、非ウイルス性肝細胞がんではSFXN1低発現群は無再発生存率(P=0.007)と全生存率(P<0.001)が非常に悪いこともわかった。
SFXN1ノックアウト肝細胞がん細胞、脂肪の取り込み少なくミトコンドリア内ROSレベルが低い
次にCRISPR/Cas9システムを用いてヒト肝細胞がん株においてSFXN1をノックアウトした。SFXN1ノックアウト細胞はコントロール細胞と比較しても細胞増殖能に差はなかった。しかし、飽和脂肪酸であるパルミチン酸に曝露させると、SFXN1ノックアウト細胞はコントロール細胞よりも生存率が高いことがわかった。パルミチン酸投与後にオイルレッド染色を行ったところ、SFXN1ノックアウト細胞はコントロール細胞よりも脂肪の取り込みが少ないことがわかった。パルミチン酸投与後にミトコンドリア内ROSを評価したところ、SFXN1ノックアウト細胞はROSレベルが低いこともわかった。以上より、SFXN1の不活性化により、脂肪を負荷しても細胞は脂肪を取り込みにくくなり、ミトコンドリア内ROS産生も抑制し、脂肪毒性の影響を受けにくくなることがわかった。
マウス生体内のSFXN1不活性化、脂肪負荷による腫瘍の増殖抑制は誘導されない
生体内での脂肪毒性を評価するためにSFXN1ノックアウト細胞とコントロール細胞を免疫不全マウスに皮下移植し、担がんマウスに通常食と高脂肪食を投与した。その結果、コントロール細胞では高脂肪食投与群は通常食投与群よりも腫瘍が小さくなったが、SFXN1ノックアウト細胞ではこのような現象は認められなかった。腫瘍組織について免疫染色を行ったところ、コントロール細胞では高脂肪食投与によりKi-67ラベリングインデックスが低下しているのに対して、SFXN1ノックアウト細胞ではほとんど変化せず、SFXN1ノックアウト細胞では脂肪負荷による細胞増殖抑制が誘導されていないと考えられた。以上より、SFXN1の不活性化は生体内でも脂肪毒性の軽減に寄与していることが示唆された。
SFXN1不活性化、フェロトーシスを阻害しがん細胞の生存・増殖を可能にすると推測
SFXN1はアミノ酸であるセリンをミトコンドリア内膜に輸送するトランスポーターであり、セリンワンカーボン代謝経路において重要な役割を果たしている遺伝子である。SFXN1は肝臓で高発現しており、肝臓ではセリンワンカーボン代謝経路からNADPHを産生し脂肪酸を合成していることが報告されている。実際、マウスにおいてセリンワンカーボン代謝経路を阻害すると肝臓での脂肪酸合成が減少し、脂肪肝が改善することもわかっている。また、SFXN1は細胞質内の鉄をミトコンドリアに供給し、ミトコンドリア内ROS産生とフェロトーシスに関与していることも知られている。フェロトーシスは細胞内ROSが増加すると鉄を触媒として過酸化膜脂質を生成し、細胞死を誘導するという最近発見されたプログラム細胞死の一つであり、肝障害に対する治療標的の一つとして注目されている。SFXN1はROS産生・脂質代謝・鉄代謝に関与する遺伝子であるので、SFXN1の不活性化はフェロトーシスを阻害することでメタボリックシンドローム・脂肪肝という環境下においてもがん細胞が生存・増殖するのを可能にしていると考えられる。
「SFXN1に関する本研究は非ウイルス性肝細胞がんの予後予測だけでなく、発症メカニズムの解明により予防治療などへの応用に役立つ可能性がある」と、研究グループは述べている。
▼関連リンク
・東京医科歯科大学 プレスリリース



