T細胞へのブレーキを解除し抗腫瘍効果を復活させる、ICB療法
東京医科大学は6月6日、がん特異的T細胞を抑制する免疫チェックポイント分子の集合体(PD-1マイクロクラスター)の超解像分子イメージング観察を行い、免疫チェックポイント阻害(ICB)抗体の新たなin vitro効果判定方法を開発したと発表した。この研究は、同大免疫学分野の横須賀忠主任教授、熊本大学大学院医学教育部博士課程4年の西航大学院生、生命科学研究部呼吸器外科・乳腺外科学の鈴木実教授、東京医科歯科大学大学院医歯学総合研究科分子免疫学分野の東みゆき教授らの研究グループによるもの。研究成果は、「Nature Communications」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
ヒトの体内では1日に3,000個のがん細胞が生まれているが、発がんには至らない。それは「免疫監視」と呼ばれるチェック機構が働き、免疫細胞が小さながんの芽を摘んでいるからである。がんに近い所属リンパ節では、がんの抗原が免疫細胞、特にT細胞へと提示され、活性化したT細胞は体内を循環し、がん細胞に遭遇するとこれを殺す。この好循環は、「がん免疫サイクル」と呼ばれている。しかし、ひとたび体力が衰えたり、がんが少し大きくなったりすると、がんは周囲を自らにとって住みやすい環境に作り変える、いわゆる「がん微小環境」を構築する。このようにがん免疫サイクルが破綻することで、がん細胞は急速に成長し発がんに至る。
2018年にノーベル医学・生理学賞を受賞した免疫チェックポイント分子阻害(ICB)療法は、これまで治療の選択肢がなかった末期がん患者に対する奏効率から、2014年に日本国内で認可されると瞬く間にがんの標準治療になった。がん微小環境が成立する最も重要な原因は、腫瘍に浸潤したT細胞(TIL)に高発現する免疫チェックポイント分子PD-1と、腫瘍が高発現するPD-1のリガンドPD-L1との結合である。ICB抗体は、この結合を阻害し、疲弊状態に陥っていたTILのPD-1抑制シグナル(T細胞へのブレーキ)を解除し、抗腫瘍効果を復活させる。
ICB抗体の使い分けや投与量、根拠をもって決定するためにin vitroの評価系が必要
日本で認可されているICB抗体には、抗PD-1抗体2種類(nivolumab、pembrolizumab)と抗PD-L1抗体3種類(durvalumab、atezolizumab、avelumab)とがある。がん種、進行度、前治療の効果などによる使い分けはあるが、投与量も含めて、なぜこの抗体をこの投与量で使用するのか、科学的な根拠は不明な点も多く残されている。ICB療法の効果判定は既存の化学療法との比較が多く、それぞれのICB抗体同士を比較した治験はない。また、投与量も多くは第1相試験で用いられた投与量が踏襲され、致命的な副作用が現れない過剰量が用いられる場合もあるし、実際にICB抗体間でも差がある。
このような問題が生じる理由の1つとして、臨床試験の複雑さがある。治療効果が確定していない新薬を実際の患者に試すことは、倫理的にも不利益にならない条件設定が必須で、莫大な費用も必要である。どのようながん種や病態の時に、どの抗体をどれだけ投与すれば効果が期待できるかなどの細かい条件設定を治験に組み込むことは現実的には不可能である。効果判定予測の精度を上げるシミュレーションなどが進むと同時に、薬剤効果を治験の前段階にin vitroの実験系で評価するプロセスは益々必要とされている。
高解像度イメージングシステムで、各ICB抗体のPD-1/PD-L1結合阻害効果を直接比較
研究グループはこれまで、抗原提示細胞やがん細胞の細胞膜を模倣した人工平面脂質膜(SLB)と超解像顕微鏡とを用いることで、1分子レベルの解析も可能な独創的かつ先端的な分子イメージングシステムを構築してきた。このシステムを用いて、マウスPD-1とPD-L1とが結合してできるPD-1の集合体「PD1マイクロクラスター」がT細胞受容体(TCR)シグナルを抑えT細胞を疲弊状態に陥らせている現象を解明し、高い評価を得ている。
今回の研究では、この分子イメージングシステムを全てヒトPD-1観察用にバージョンアップし、上記の未解決問題であるICB治療抗体のPD-1-PD-L1結合阻害効果を直接比較し、実際に必要とされる投与量の算出や、より効率的なICB抗体の組み合わせの提案など、より臨床に必要とされる基盤情報の提案を目指した。
人工がん細胞脂質二重膜を作製し、ヒトPD-1挙動を確認する新たな実験系を確立
今回、ヒトPD-1マイクロクラスターを可視化し、さらに実際に医療で使用されているICB抗体のPD-1阻害効果を検証するため、ヒトPD-1の1細胞1分子イメージングの新たな実験系を確立した。まず、ヒトPD-1リガンドであるヒトPD-L1もしくはヒトPD-L2を組み入れた「人工がん細胞脂質二重膜」を作製し、その上にヒトPD-1を発現しているT細胞をのせ、ヒトPD-1の挙動を観察した。T細胞は数分をかけて脂質二重膜に接着し、その接着面に連続的に形成される、PD-L1との結合を機にヒトPD-1分子が数十個集まったクラスターが観察された。
PD-1のクラスターは、同時にMHCとの結合を機にできるTCRの凝集「TCRマイクロクラスター」と同じ位置に形成されるだけでなく、TCRシグナルを抑制する脱リン酸化反応を担う酵素(フォスファターゼ)SHP2を呼び寄せ、TCRマイクロクラスターで起きているリン酸化反応を減弱させた。この実験から、ヒトPD-1もマウスPD-1と同様に「抑制性PD-1マイクロクラスター」としてT細胞を抑制・疲弊させることがわかった。
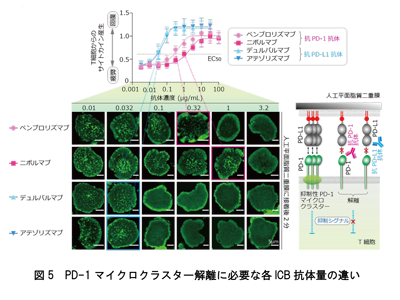
実臨床で使用される各ICB抗体、T細胞機能回復に要する最低濃度に差があった
人工がん細胞脂質二重膜を用いた実験系に、実際に臨床で使用されているICB抗体を加え、PD-1マイクロクラスターの有無を観察した。それぞれの抗体を添加することでPD-1マイクロクラスターの解離、つまりT細胞抑制の解除、疲弊からの回復が確認されたが、それぞれの抗体では必要とする最低濃度に差があることがわかった。また、これらの濃度はサイトカイン産生能やがん抗原特異的細胞傷害活性などT細胞機能回復に必要とする抗体濃度と一致していた。ゆえに1細胞1分子イメージングはT細胞機能も反映していること、また、これまで直接比較がされていない種々のICB抗体には機能的な差があることがわかった。
2種の抗体を組み合わせる場合、PD-1同士/PD-L1同士より、PD-1+PD-L1が効果的
実験から算出された各ICB抗体の至適濃度に基づき、2つの抗体を組み合わせて用いた場合どのペアがよりT細胞疲弊を回復させるか検討した。まず最大効果の20%の効果が期待される抗体必要量(EC20)を用いて、1細胞1分子イメージング観察を行ったところ、抗PD-1抗体と抗PD-1抗体とのペア、あるいは抗PD-L1抗体と抗PD-L1抗体とのペアよりも、抗PD-1抗体と抗PD-L1抗体など異なる抗原性をもつ抗体の組合せの方が、よりPD-1マイクロクラスターを解離させることがわかった。同様に50%の効果が期待される抗体必要量(EC50)の組み合わせでサイトカイン産生能を検討しても、異なる抗原性をもった抗体の組合せの優位性が確認された。
実臨床に即さない側面も残るが、in vitroでの簡便な機能評価として強力なツールとなり得る
現在治療に使われている免疫チェックポイント分子阻害(ICB)抗体には、(1)標的抗原、(2)抗原結合部位(エピトープ)、(3)アイソフォーム、(4)抗体依存性細胞傷害活性(ADCC)の有無、(5)ヒト化抗体へのキメラ化などの違いにより、それぞれ機能的特徴があると考えられている。特にアイソフォームやADCC活性の有無の違いは、ICB抗体の生体内での動態に強く影響する。これらの点を考慮すると、今回の研究のようなin vitroの実験系で導き出された結果には、実臨床に即さない側面も残されている。
しかし、実際にヒトに投与する治験では細かな条件設定が難しいこと、また新規治療薬同士を直接比較することは社会的にも困難である。ゆえに、その有用性を実証した1細胞1分子イメージングシステムを用い、抑制性PD-1マイクロクラスターの動態を観察することは、in vitroで行える簡便な機能評価として、新規開発薬のドラッグスクリーニングにおける強力なツールと考えられる。「この『人工がん細胞脂質二重膜』はキメラ抗原受容体(CAR)-T細胞や二重特異性抗体(BiTE)へも応用でき、今後がん治療における新規生物製剤やデザイン開発においても応用が期待される」と、研究グループは述べている。
▼関連リンク
・東京医科大学 プレスリリース




