間葉性軟骨肉腫、AYA世代に発生する悪性度の高いがん
東京医科大学は5月23日、骨軟部肉腫の1つ・間葉性軟骨肉腫のモデル化に成功し、融合遺伝子HEY1-NCOA2による軟骨細胞分化への干渉機構を明らかにしたと発表した。この研究は、同大医学総合研究所未来医療研究センター実験病理学部門の中村卓郎特任教授、がん研究会がん研究所がんエピゲノムプロジェクトの田中美和主任研究員、丸山玲緒プロジェクトリーダーらの共同研究グループによるもの。研究成果は、「JCI Insight」オンライン版に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
骨軟部肉腫はがん全体の1%程度を占める希少がんで、さらに50以上の異なる性質の腫瘍に細分化されることから、個々の肉腫の診断や治療には高度の専門性と、それぞれの疾患特有の病態に対する正確な知識が要求される。間葉性軟骨肉腫もその一つで、AYA世代に発生する悪性度の高いがんであり、予後不良で有効な治療薬のない腫瘍として、疾患の正しい理解を通した治療法開発が待たれている。
治療法開発のためには、生体内で病態を正確に再現する動物モデルが不可欠である。しかし、同疾患では原因遺伝子HEY1-NCOA2を導入して腫瘍の発生機構を解き明かすモデル系がこれまで存在せず、HEY1-NCOA2の発現がどうして発生期の軟骨分化を模倣しながら悪性化を惹起させるのか、多くの不明点が存在していた。
マウス間葉性肉腫モデルで分化経路を明らかに
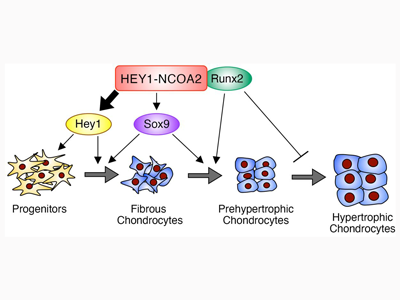
今回研究グループは、世界で初めて、原因融合遺伝子HEY1-NCOA2をマウス軟骨前駆細胞に導入したモデルの開発に成功した。間葉性軟骨肉腫の特徴とされる未分化間葉性細胞と硝子軟骨の二層性構造が正確に再現されるとともに、軟骨発生に特徴的な制御因子や構造タンパク質、マーカー分子の発現も示された。さらに腫瘍から単一細胞に分離してRNAシークエンシングを行うと、腫瘍の分化経路を辿ることが可能となり、それぞれのコンパートメントに対応する軟骨分化関連遺伝子との関係性が明らかになった。
SOX9とRUNX2が腫瘍細胞全体に、HEY1が未分化細胞に強く発現しHEY1-NCOA2と共存
軟骨の分化は、SOX9やRUNXファミリー、HEY/HESファミリーといった転写因子による遺伝子の発現調節を介して制御されている。間葉性軟骨肉腫では、SOX9とRUNX2が腫瘍細胞全体に、HEY1が未分化細胞に強く発現され、HEY1-NCOA2と共存していることがわかった。HEY1-NCOA2はエンハンサーにしばしば結合して内在性HEY1の発現をドライブするとともに、DNAへの結合に際してRUNX2と複合体を形成していることがわかり、新たな転写ネットワークの存在が示唆された。間葉性軟骨肉腫でRUNX2をノックアウトすると、成熟軟骨成分が消失し悪性度が高くなることから、RUNX2とHEY1のバランスが腫瘍の形態と悪性化に重要である可能性も考えられた。
HDAC阻害薬パノビノスタットの有効性を示唆
間葉性軟骨肉腫に対して効果のある薬剤は、現状あまり知られていない。今回、ヒストン脱アセチル化酵素阻害薬の一つであるパノビノスタットの投与により、マウス間葉性軟骨肉腫の顕著な増殖阻害が確認された。
間葉性軟骨肉腫は、その希少性から外科的切除以外の治療法は確立していない。今回、新たなプレクリニカルモデルを創出したことは、既存治療薬の評価や創薬につながるものと期待される。「軟骨発生と分化における転写ネットワークの重要性は知られているが、原因融合遺伝子HEY1-NCOA2による干渉作用を明らかにしたことは、軟骨の再生や炎症・老化といった病態の解明にも資するものと考えられる」と、研究グループは述べている。
▼関連リンク
・東京医科大学 プレスリリース




