母体免疫寛容が生じる胎盤、胎児を感染症から守るメカニズムは?
国立成育医療研究センターは4月19日、細胞モデルを用いてヒト胎盤の免疫学的機能を解析し、胎盤がウイルス感染防御に特化した機構を持つことを明らかにしたと発表した。この研究は、同国研究センター免疫アレルギー・感染研究部の本村健一郎研究員、松本健治部長、周産期・母性診療センターの左合治彦センター長らの研究グループによるもの。研究成果は、「Journal of Immunology」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
胎盤は母体と胎児をつなぐ妊娠に欠かせない臓器であり、胎児の発育と生命維持を担っている。胎盤は胎児と同じく両親からの遺伝子で形成されるため、母体から見て胎児・胎盤は免疫学的に半分非自己であり、胎盤は免疫寛容によって母体の免疫システムによる拒絶から免れている(母児免疫寛容)。この状態は、胎盤が何らかの感染にさらされた際には、感染を抑える免疫がうまく働かない可能性があるため不利益として働くことが想定される。しかし、実際には、胎盤が胎児を多くの感染症から守っていることが知られている。しかし、そのメカニズムは明らかになっていない。
成育医療研究センターでは、倫理委員会の承認を得て、同センター産科で分娩した妊婦から胎盤の提供を受け、その細胞(栄養膜細胞)を有効に保管・培養する方法を確立している。今回の研究では、ヒト胎盤由来の栄養膜細胞を安定的に培養できる技術を用いて、胎盤の免疫学的特性を検討した。
ヒト胎盤にはウイルス防御に重要な二本鎖RNA受容体が発現
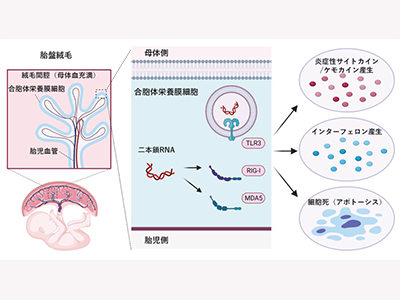
まず、ヒト胎盤由来初代分化栄養膜細胞モデルの自然免疫系受容体の発現・機能スクリーニングを実施。その結果、同細胞にはウイルス感染に対する防御に重要な役割を果たす二本鎖RNA受容体が特異的に発現していた。一方、細菌など他の病原体を認識する受容体は発現していないことが明らかになった。
二本鎖RNAにより抗ウイルス作用を持つIFN産生、細胞死を誘導
次に、ヒト胎盤由来初代分化栄養膜細胞モデルの二本鎖RNA受容体が刺激された際に起こる遺伝子発現変化をマイクロアレイで網羅的に解析。その結果、抗ウイルス作用および細胞死に関連した遺伝子群が変動していることがわかった。そこで、実際に細胞モデルを用いて検討し、二本鎖RNAはヒト胎盤において抗ウイルス作用を持つサイトカインであるインターフェロンの産生を誘導すること、またミトコンドリア経路を介した細胞死(アポトーシス)を誘導することを証明した。
胎盤の合胞体栄養膜細胞、ウイルス感染時に細胞死を自ら誘導して防御の可能性
ウイルス感染に対する獲得免疫系の応答は、B細胞からの抗体産生、T細胞によるウイルス感染細胞の特異的な細胞死誘導が知られている。このうち、T細胞による特異的な細胞死誘導に必須の分子が発現していないために、胎盤の合胞体栄養膜細胞はウイルス感染時に細胞死を自ら誘導して防御を行う機構が備わっていると、研究グループは推察している。
風疹ウイルスなど垂直感染の予防方法確立に寄与の可能性
今回の研究成果は、サイトメガロウイルスや風疹ウイルスによる胎児の胎内ウイルス感染(垂直感染)のメカニズム解明に役立ち、将来的にその予防方法の確立に寄与できる可能性がある。さらに、胎盤の炎症は多くの妊娠合併症の原因となっていることが示唆されているため、先天性ウイルス感染症だけでなく、二本鎖RNAの作用による胎盤の炎症が妊娠合併症発症のトリガーになっている可能性についてさらなる研究が望まれる、と研究グループは述べている。
▼関連リンク
・・国立成育医療研究センター プレスリリース



