なぜ、ラミンAの遺伝子変異が重症心不全をもたらすのか?
東京大学は4月17日、重症拡張型心筋症の病態を解明し、新たな治療標的を同定したと発表した。この研究は、同大医学部附属病院の山田臣太郎特任研究員、候聡志特任助教、伊藤正道特任助教、野村征太郎特任准教授、小室一成教授(研究当時)、理化学研究所環境資源科学研究センターの佐藤繭子技師、豊岡公徳上級技師、東京医科歯科大学生体材料工学研究所の池内真志教授、神戸大学大学院医学研究科の仁田亮教授、国立成育医療研究センター研究所の高田修治部長、梅澤明弘所長、東京大学先端科学技術研究センターの油谷浩幸シニアリサーチフェロー(特任研究員)らの研究グループによるもの。研究成果は、「Science Advances」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
心不全患者は増加の一途を辿っており、高齢化の影響もあって2030年には米国で約800万人、日本で約130万人に達すると推計されている。心不全患者には、さまざまな内科的・外科的治療が試みられているが、依然として生存率は悪く、通常では心不全と診断されてから5年間のうちでの死亡率は約50%にも上ると考えられている。心不全は、さまざまな心疾患によって引き起こされるが、その中でも拡張型心筋症は日本における心臓移植の原因疾患の6~7割を占めるほど重症心不全を引き起こすことが知られている。
研究グループは過去に、日本の拡張型心筋症患者のゲノム解析を行い、核ラミナの主要構成要素の一つであるラミンA遺伝子(LMNA)に生じる遺伝子変異は特に重症な拡張型心筋症を引き起こすことを報告してきた。一方で、なぜLMNAの遺伝子変異が重症心不全をもたらすのかはいまだ明らかでないことも多く、治療法の開発もまだ不十分と言える。
LMNA Q353Rモデルマウスを樹立、心筋細胞内の構造異常を確認
研究グループはまず、重症拡張型心筋症の患者家系の遺伝子解析によって同定した遺伝子変異(LMNA Q353R)を再現した疾患モデルマウスおよび疾患特異的iPS心筋細胞を樹立した。これらを高圧凍結・凍結置換法による電子顕微鏡技術等によって解析した結果、心筋細胞内の核やサルコメアに構造異常があることが明らかとなった。
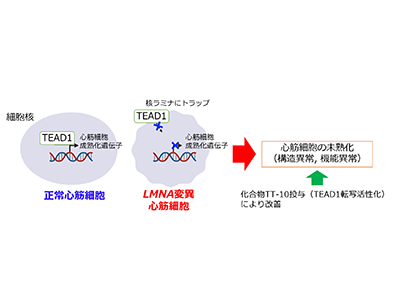
変異ラミンで構成の核ラミナにTEAD1がトラップされ心筋細胞が未熟に
続いて、シングルセルRNA-seq解析およびATAC-seqを行い、LMNA Q353R変異心臓では転写因子TEAD1によって制御される心筋細胞成熟化遺伝子の発現が上手く機能していないため、未熟な心筋細胞が多くなることを明らかにした。
さらに、変異型iPS心筋細胞を用いてプロテインアレイ解析や免疫染色解析を行うことで、変異型ラミン分子がTEAD1と強く結合し、その結果として変異型iPS心筋細胞ではTEAD1が変異型ラミン分子のある核ラミナに多く結合していることが判明。つまり、変異型ラミンによって構成された核ラミナにTEAD1がトラップされることにより本来のTEAD1の働きが損なわれ、その結果として心筋細胞が成熟化できずに未熟な状態となることがLMNA Q353R変異拡張型心筋症による心不全のメカニズムと考えられた。
TEAD1を活性化するTT-10投与で心筋細胞の成熟化が正常化
そこでTT-10という、同研究グループが以前独自に開発したTEAD1の転写活性を上げる化合物を変異型iPS心筋細胞に投与した結果、TEAD1によって制御される遺伝子発現が正常化し、心筋細胞としての機能も回復することが明らかになった。
今回の研究で、疾患モデルマウスや疾患特異的iPS心筋細胞が樹立され、多様な解析を通して重症拡張型心筋症患者の病態が明らかとなり、新たな治療ターゲットや治療薬候補が発見された。個別化医療や精密医療の重要性が叫ばれて久しいが、同研究のように、患者ごとに病態を詳細に解明することが個別化医療を実践する上で重要と考えられる。
「今回の成果を発展させ、さまざまな解析技術を駆使して重症心不全を引き起こす疾患の解析を進め、さらなる心不全の治療成績向上を目指していく」と、研究グループは述べている。
▼関連リンク
・東京大学医学部附属病院 プレスリリース




