表皮のように口腔粘膜にも存在する透過性バリア、形成に関わる脂質分子は不明
北海道大学は4月13日、セラミドが口腔バリア形成に重要であることを明らかにしたと発表した。この研究は、同大大学院薬学研究院の佐々貴之准教授、木原章雄教授らの研究グループによるもの。研究成果は、「Cell Reports」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
生物には環境から身を守るバリアが存在する。例として、皮膚の表皮において外界からの病原体、アレルゲン、化学物質の侵入や乾燥を防ぐ透過性バリア(皮膚バリア)や眼球表面を覆う涙液による涙液バリアが挙げられる。これらのバリアの形成には脂質が重要であり、皮膚バリアではセラミド、涙液バリアではコレステリルエステルやワックスエステルなどの脂質がバリア形成に関わっていることが知られている。口腔粘膜にも透過性バリア(口腔バリア)が存在しているが、口腔バリア形成に関わる脂質分子は不明だった。しかし口腔粘膜と表皮は類似した組織学的特徴をもつため、研究グループは口腔バリアの形成にもセラミドが関わっている可能性があると考えて研究を行った。
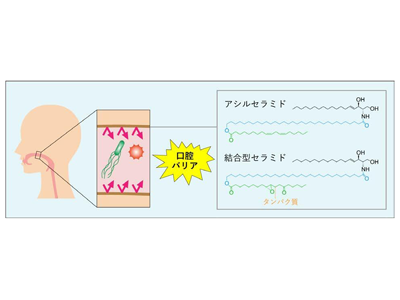
セラミドは二つの炭化水素鎖である脂肪酸と長鎖塩基が結合した分子で、一般的なタイプである非アシル化セラミド、アシルセラミド(別名EO)、結合型セラミド(別名P-O)に大別される。これらはさらに長鎖塩基部分の違いからなる複数のクラスに分類される(例:アシルセラミドEOS/EODS/EOP/EOH、結合型セラミドP-OS/P-ODS/P-OP/P-OHなど。S/DS/P/Hは長鎖塩基部分の違いを表す)。アシルセラミドは長い炭素鎖長をもつ脂肪酸の末端に、さらにもう一つの脂肪酸(おもにリノール酸)がエステル結合した特殊な構造をもつ。
一方、結合型セラミドは、表皮の角質細胞表面のタンパク質と強く結合(共有結合)している。結合型セラミドはアシルセラミドの代謝によって産生される。アシルセラミドと結合型セラミドは共に皮膚バリア形成において特に重要であり、これらのセラミドの産生不全は魚鱗癬と呼ばれる皮膚疾患を引き起こす。これまでの研究によって表皮のセラミド組成の詳細は明らかになっていたが、口腔粘膜に存在するセラミド分子種の詳細は明らかにされておらず、セラミドが口腔バリアの形成に関わるかどうかも不明だった。
口腔粘膜におけるセラミドについて、質量分析法とマウス実験で調査
そこで研究グループは口腔粘膜のセラミド分子種の詳細を調べた。また、研究グループは口腔粘膜においてアシルセラミドと結合型セラミドの産生量を大きく減少させたマウスを人工的に作り出し、アシルセラミドと結合型セラミドが口腔バリアに重要であるかどうか調べた。
マウスの口腔粘膜(頬、舌)と消化管(食道、胃、小腸、大腸)の組織およびヒトの頬と歯茎から綿棒で採取した口腔粘膜細胞から非アシル化セラミド、アシルセラミド、結合型セラミドを含む脂質を抽出し、得られた脂質に含まれるセラミドを質量分析法によって解析した。口腔バリアにおけるアシルセラミドと結合型セラミドの役割を明らかにするため、脂肪酸の炭素鎖長を伸ばす酵素(脂肪酸伸長酵素)の一つであるELOVL1をコードするElovl1遺伝子が口腔粘膜と食道で欠損した「Elovl1 cKOマウス」を作製し解析した。ELOVL1によって産生される長い炭素鎖長をもつ脂肪酸はアシルセラミドと結合型セラミドの産生に必要なため、Elovl1 cKOマウスではアシルセラミドと結合型セラミドの産生量が低下すると予想された。
ヒトの口腔粘膜にアシルセラミドと結合型セラミドを確認
マウスの口腔粘膜(頬、舌)と消化管(食道、胃、小腸、大腸)には11クラスの非アシル化セラミドが存在していた。また、口腔粘膜(頬、舌)と食道、胃にはアシルセラミドと結合型セラミドも存在していた。これらの組織のアシルセラミドと結合型セラミドの主要なクラスはそれぞれEOSとP-OSであり、いずれもSタイプの長鎖塩基をもつクラスだった。一方、小腸と大腸にはアシルセラミドと結合型セラミドがほぼ存在していなかった。ヒトの口腔粘膜細胞(頬、歯茎)には15クラスの非アシル化セラミドと5クラスのアシルセラミドが存在し、このうち、頬にはアシルセラミドのEOS、EODS、EOP、歯茎にはさらにEOHが存在していた。意外なことに、歯茎の粘膜細胞にはP-OSクラスの結合型セラミドが存在する一方、頬の粘膜細胞には結合型セラミドが存在しなかった。マウスの口腔粘膜(頬、舌)とヒトの歯茎の粘膜は角化しているのに対し、頬の粘膜は角化していないことから、角化と結合型セラミドの産生との関連が示唆された。
アシルセラミドと結合型セラミド産生に必要な酵素を欠損したマウス、口腔バリアが低下
Elovl1 cKOマウスの口腔粘膜(頬、舌)、食道、胃のセラミドを測定した結果、口腔粘膜(頬、舌)ではアシルセラミドと結合型セラミドの量が約3分の1以下に減少し、食道では結合型セラミドの量が約5分の1に減少していた。このように、アシルセラミドと結合型セラミドの量が口腔粘膜で減少したマウスの作製に成功した。
Elovl1 cKOマウスの口腔組織を調べたところ、舌の角質層が肥厚していた。これは魚鱗癬の皮膚病態と類似していた。次に、Elovl1 cKOマウスの口腔バリアを調べた。マウスの舌を蛍光物質溶液に浸し、粘膜表面から浸透した蛍光物質が発する蛍光を組織学的に定量したところ、Elovl 1cKOマウスの舌粘膜は正常なマウスよりも蛍光色素が浸透しやすいことがわかった。特に、舌の下面では約2倍以上の透過性を示した。また、行動学的方法として、辛味をもたらすカプサイシン入りの水を与えて反応を調べたところ、正常なマウスではカプサイシン入りの水を飲む量が普通の水の64%に減少し、カプサイシンに対する軽度の忌避性が見られたのに対し、Elovl1 cKOマウスでは普通の水の9.5%に減少し、重度の忌避性が見られた。これらの結果から、アシルセラミドと結合型セラミドが口腔バリアに重要であることが明らかになった。
口腔疾患とセラミドの関係解明や、治療薬の開発に期待
今回の研究は口腔粘膜に存在するセラミド分子種の詳細を解明し、アシルセラミドと結合型セラミドが口腔バリアに重要であることを初めて明らかにした。また、アシルセラミドと結合型セラミドがヒトの口腔粘膜にも存在することを解明した。「本研究成果は、セラミドと口腔疾患との関係の解明や新たな口腔疾患の治療薬の開発につながることが期待される」と、研究グループは述べている。
▼関連リンク
・北海道大学 プレスリリース



