NAFLDは複雑なプロセスで起こるため、疾患メカニズムはほとんど未解明
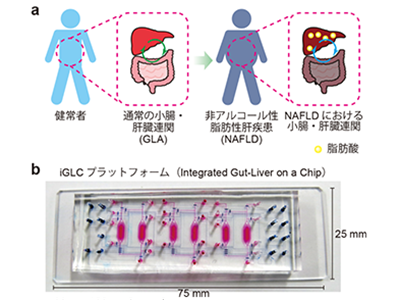
京都大学は4月5日、世界的に患者数が増加傾向にある非アルコール性脂肪性肝疾患(NAFLD:Non-alcoholic fatty liver disease)を生体外において研究するため、小腸と肝臓を連結した臓器チップの開発に成功したと発表した。この研究は、同大アイセムスの亀井謙一郎客員准教授(ニューヨーク大学アブダビ校准教授兼任)、同大大学院工学研究科工学基盤教育研究センターの平井義和講師(同機械理工学専攻講師兼任)、同マイクロエンジニアリング専攻楊建東博士らの研究グループによるもの。研究成果は、「Communications Biology」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
世界的に患者数が増加傾向にあるNAFLDは、肝脂肪症、肝硬変、がん、心血管疾患につながる慢性肝疾患だ。現在、重度の肝疾患患者の治癒には肝移植が唯一の方法だが、患者に適したドナーを見つけることは非常に困難であることが問題となっている。NAFLDの段階で治療できれば肝移植は回避できるが、非常に複雑なプロセスで起きるため、その疾患メカニズムはほとんど解明されていない。NAFLDに対する新しい治療薬を開発するためには、これらの各プロセスを深く理解する必要がある。
NAFLDの発症と進行に最も重要なGLA研究のためには「生体外モデル」が必要
研究グループは、NAFLDの発症と進行に最も重要な要素の一つである腸と肝臓の相互作用「腸-肝臓軸(GLA; Gut-liver axis)」に着目した。腸と肝臓は複雑に関連しており、NAFLDに起因する腸内細菌異常症、粘膜透過性変化などによるGLA機能障害は、治療のターゲット候補として挙げられているが、現在までに実用化された治療法はない。NAFLDにおけるGLAを研究するために簡便な生体外モデルを確立することができれば、新薬、治療法、診断ツールの発見に貢献できる。
GLAの生体外モデルを開発するため、研究グループは臓器チップ技術を用いることにした。臓器チップとは、マイクロ流体技術を利用することで細胞の微小環境を時空間的に制御し、組織細胞の機能を模倣するデバイスシステムの総称。従来の細胞培養法では難しい血液循環を再現した異なる組織細胞間で細胞培養液を循環させることで、多臓器間相互作用の生体外モデル化を可能にする。
iGLCプラットフォームを開発、初期および進行性NAFLDを表した細胞状態の誘導に成功
そこで研究グループは今回、iGLCプラットフォーム(Integrated Gut-Liver on a Chip)と呼ばれる腸・肝連結臓器チップを開発し、NAFLDの病態メカニズムについての研究を行った。このiGLCプラットフォームには、細胞培養液の流れを高精度に制御するマイクロバルブやポンプがチップ内に搭載されており、細胞培養チャンバへの個別アクセスと、小腸・肝臓細胞を接続する培養液循環フローを実現している。
このプラットフォームを用いて、腸と肝細胞を共培養し、NAFLDを誘引することで知られる遊離脂肪酸(FFA; Free Fatty Acid)を投与することで、初期および進行性NAFLDを表した細胞状態(細胞内脂質貯蔵など)を誘導することに成功した。さらに、mRNAシークエンシング(mRNA-seq)と顕微鏡イメージングによるシングルセル・プロファイリングを組み合わせて、NAFLD状態における独自の細胞表現型変化と関連する遺伝子ネットワークを調査した。
iGLCプラットフォームによる循環灌流は従来法に比べ、組織機能発現に適した環境を実現可能
同研究で開発したiGLCプラットフォームは、ガス透過性、生体適合性、透明性の高いシリコーン樹脂(PDMS; Polydimethylsiloxane)を成形加工(多層ソフトリソグラフィ技術)した小腸・肝臓細胞を培養するための灌流層と細胞培養液の流れを制御するための制御層で構成されている。灌流層には、マイクロ流路(幅200µm、高さ45µm)で接続された2つの細胞培養チャンバー(幅2.1mm、高さ220µm)が3セットある。制御層には、薄いPDMS膜(200×200µm2、20µmの厚さ)で形成された圧力駆動型マイクロバルブとポンプを設置している。2種類以上の組織細胞の相互作用を調べるには、細胞培養チャンバの接続・分離を自在に操作できる必要がある。
iGLCプラットフォーム内の個々の細胞培養チャンバに小腸細胞であるCaco-2細胞と肝実質細胞であるHepG2細胞をそれぞれ個別に導入し、続いて細胞培養液をポンプで循環して共培養することで、生体外におけるGLAを再現した。従来法で培養したCaco-2細胞の機能化には21日間程度培養する必要があるが、iGLCプラットフォームの循環条件下では7日間で機能を発揮することが確認できた。また、培養液を循環することによって、HepG2細胞の生存率は変わらなかったものの、Caco-2細胞の生存率は向上していたという。さらに共培養下のHepG2細胞は、単培養と比較してアルブミンの発現が増加したため、肝機能性が向上していることが観察された。
以上より、iGLCプラットフォームによる循環灌流は、Caco-2細胞とHepG2細胞の両方にとって、従来の生体外細胞培養法よりも良い組織機能発現に適した環境を実現できることが示された。
iGLCプラットフォーム内でのGLA相互作用とNAFLDの再現に成功
次に、iGLCプラットフォーム内でNAFLDを再現するため、遊離脂肪酸を添加した細胞培養液をプラットフォームに導入した。プラットフォーム内では、Caco-2細胞とHepG2細胞の共培養だけでなく単培養も行い、Caco-2細胞とHepG2細胞の相互作用についても検討した。
その結果、共培養下のCaco-2細胞では、単一培養細胞よりも細胞内脂質貯蔵が少なく、一方、HepG2細胞では細胞内脂質貯蔵が増加していることを確認。iGLCプラットフォーム内でのGLA相互作用とNAFLDの再現に成功した。
Caco-2/HepG2細胞が遊離脂肪酸に対して保護的に作用していることを新たに発見
さらに、遊離脂肪酸によるGLAの遺伝子発現に及ぼす影響を明らかにするため、mRNA-seqを実施。その結果、Caco-2細胞とHepG2細胞の双方において、「1mMのFFAs処理の有無」「単培養と共培養」の合計4種類の条件下において、遺伝子発現の差異が確認できた654遺伝子(Caco-2細胞)と1,330遺伝子(HepG2細胞)を同定した。Caco-2細胞、HepG2細胞ともに、共培養することにより、遊離脂肪酸による遺伝子発現制御が軽減されていることが確認された。
個別に培養している従来の細胞培養実験法ではなくiGLCプラットフォームを用いることで、Caco-2細胞とHepG2細胞が遊離脂肪酸に対して互いに保護的に作用しているということが新たに確認された。
NAFLD発症に関する知見と、薬剤候補発見への貢献に期待
今回の研究により、iGLCプラットフォームを用いてNAFLDを再現する新しい生体外ヒトモデルが開発された。将来的には創薬スクリーニングや各種オミックステクノロジーと組み合わせることで、NAFLD発症に関するより深い知見と、薬剤候補の発見への貢献が期待される。
「iGLCプラットフォームは、炎症性腸疾患など、GLAに関連するさまざまな障害に関する新しい知見や治療薬の開発への貢献も期待される。さらに、実験動物を使用しない疾患研究が可能になるので、新しい動物代替法としての活躍も期待できる」と、研究グループは述べている。
▼関連リンク
・京都大学アイセムス 物質-細胞統合システム拠点 研究




