二次進行型多発性硬化症、詳細な分子機序は明らかでない
国立精神・神経医療研究センター(NCNP)は3月22日、神経変性病態に関連して出現する2種類のミクログリア亜集団が、免疫細胞(エオメス陽性ヘルパーT細胞)による神経細胞障害に重要な役割を果たすことを明らかにしたと発表した。この研究は、同センター神経研究所免疫研究部の張晨陽研究員、山村隆部長、大木伸司室長らの研究グループによるもの。研究成果は、「Cells」オンライン版に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
多発性硬化症(multiple sclerosis:MS)は、免疫系が自身の中枢神経系を攻撃することで発症する自己免疫疾患で、そのほとんどは発症初期に再発寛解型多発性硬化症(RRMS)と診断される。RRMSでは再発期の脳内急性炎症が特徴的だが、一般には回復しやすい病態だ。しかし、病歴が長くなると一部は神経変性を伴う二次進行型多発性硬化症(SPMS)に移行する。SPMSでは、脱髄に加えて神経細胞の不可逆的な変性が起こり、脳萎縮や、それに伴う歩行困難、認知機能障害など、進行性で重篤な中枢神経症状を呈する。有効な薬剤は限られ、薬効を説明し得る分子機序の詳細も明らかではない。
SPMSの神経変性を促進するエオメス陽性ヘルパーT細胞、脳内ミクログリアとの関係は?
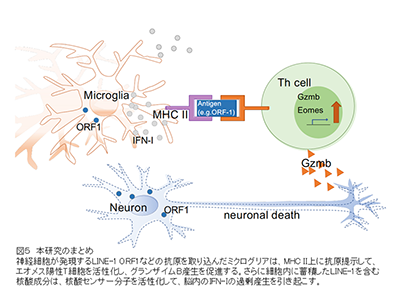
研究グループが発見したエオメス陽性ヘルパーT細胞は、SPMSや筋萎縮性側索硬化症の神経変性過程を促進するが、この細胞が神経細胞死を引き起こすためには、何らかの抗原提示細胞によって提示された抗原に反応して活性化し、細胞障害性分子グランザイムBを放出することが必須だ。長い期間に及ぶ慢性神経変性の病態では、樹状細胞やマクロファージなどの比較的寿命が短い免疫系の抗原提示細胞に代わり、脳内の免疫細胞であるミクログリアが抗原提示に関わることが予想されたが、その詳細は不明だった。
研究グループは、以前に独自開発したSPMSマウスモデルを用いて、エオメス陽性ヘルパーT細胞がSPMSの病原性細胞であることを報告している。今回の研究では、エオメス陽性ヘルパーT細胞と脳内ミクログリアとの機能的な関係を明らかにすることで、脳内でエオメス陽性ヘルパーT細胞が生成し、神経細胞障害を引き起こす過程を解明することを目的とした。
SPMSマウス、「IFNミクログリア」と「MHC IIミクログリア」が増加
まず、独自に開発したSPMSのマウスモデルでは、ミクログリアの活性化を抑えるミノサイクリンの投与によって麻痺症状が改善し、エオメス陽性ヘルパーT細胞も減少することを示した。次に、シングルセルRNA-Seq解析でさまざまなミクログリア亜集団を同定し、その中で免疫応答の制御に関わる表現型を示す2種類の細胞集団に着目。SPMSのモデルマウスでは、I型インターフェロン(IFN-I)による活性化の痕跡を示すミクログリア亜集団(IFNミクログリア)と、抗原提示に関わるMHCクラスIIを高発現するミクログリア亜集団(MHC IIミクログリア)が増加していた。
IFN-Iシグナル伝達抑制で病態が改善、エオメス陽性ヘルパーT細胞減少
この結果から、同マウスの脳内ではIFNミクログリアによってIFN-Iが大量に産生されていること、そして、脳内の未知抗原をMHC II上に提示したMHC IIミクログリアにより、エオメス陽性ヘルパーT細胞が活性化することが予測された。そこで、まずSPMSモデルマウスのIFN-Iシグナル伝達を抗IFN-I受容体抗体で抑えたところ、病態は顕著に改善し、エオメス陽性ヘルパーT細胞も著明に減少した。
ミクログリアのLINE-1由来ORF1がエオメス陽性ヘルパーT細胞の活性化抗原と判明
次に、SPMSマウスの炎症部位から神経細胞やミクログリアを分離し、その細胞内にある転写産物(mRNA)がコードする多様なタンパク質・ペプチドを発現させ、同じくSPMSマウスの炎症部位から分離したエオメス陽性Th細胞が反応するかを検証した。
スクリーニングの結果、発現させた分子の中には、MHC II上に提示されてエオメス陽性ヘルパーT細胞を活性化する抗原が存在することが確認された。これまで研究グループは、ジャンクDNAに分類され、ゲノム内を転移する因子として知られるレトロトランスポゾンLINE-1に注目してきたが、今回LINE-1由来のORF1タンパク質が、エオメス陽性ヘルパーT細胞を活性化する抗原の一つであることも明らかにした。
ミクログリアのLINE-1抗原提示とエオメス陽性ヘルパーT細胞活性化が重要な治療標的に
最後に、SPMSモデルマウスに逆転写酵素阻害剤3TCを投与してLINE-1の活性化を抑制したところ、病態が有意に改善し、エオメス陽性ヘルパーT細胞も減少することが判明した。一連の結果から、LINE-1の複製中間体などの異所性核酸の蓄積により、IFN-Iに満たされた脳内でエオメス陽性ヘルパーT細胞が生成し、LINE-1 ORF1タンパク質などの異所性タンパク質の抗原提示を受けて同T細胞が活性化すること、そして、その産生するグランザイムBが神経細胞死を引き起こす可能性が示され、これがSPMSにおける神経変性病態の発症メカニズムであることが明らかになった。
研究グループは最近、SPMSマウスモデルだけでなく、筋萎縮性側索硬化症モデルマウス(mSOD1マウス)やアルツハイマー型認知症のモデルマウス(5xFADマウス)など、より広範な神経変性疾患モデルマウスの脳内にもエオメス陽性ヘルパーT細胞が集積し、ORF1タンパク質を認識して活性化することにより、神経細胞障害因子であるグランザイムBを放出して神経細胞死を引き起こすことを報告している。神経変性疾患患者の神経細胞では、LINE-1の異所性活性化が顕著に生じているという報告が複数あることから、今回の研究で明らかとなったミクログリアによるLINE-1抗原の提示と、引き続くエオメス陽性ヘルパーT細胞の活性化が、さまざまな神経変性疾患で極めて重要な意義を持つことが予想され、治療法開発に役立つ重要な研究成果が得られたとしている。
エオメス陽性ヘルパーT細胞を介した神経変性病態形成分子機序の全容解明に期待
今回の研究成果により、さまざまな神経変性疾患の病態形成過程において、ミクログリアによるLINE-1抗原の提示と、LINE-1抗原の認識によって引き起こされるエオメス陽性ヘルパーT細胞の活性化が重要な役割を果たすことが明らかにされた。阻害抗体によるIFNシグナル抑制がエオメス陽性ヘルパーT細胞の生成を阻害したという同結果は、エオメス陽性ヘルパーT細胞の生成において、IFN-Iが重要な役割を果たすことを意味する。
LINE-1由来核酸分子の過剰産生は、核酸センサー分子を活性化してIFN-I産生を引き起こすことが容易に想像されるため、今後はこれらの点を明らかにするために、IFN-Iによるエオメス陽性ヘルパーT細胞の生成機序とLINE-1の挙動の解析を進める。近い将来、エオメス陽性ヘルパーT細胞を介した神経変性病態形成の分子機序の全容解明が進むことが期待できる。さらに、LINE-1の活性化を抑制する逆転写酵素阻害剤が、有意な病態改善効果とエオメス陽性ヘルパーT細胞の抑制効果を示したことは、LINE-1阻害が、神経変性病態の新たな治療アプローチとなり得ることを示しており、有効な治療法がない神経変性疾患の新しい治療戦略につながることが期待されると、研究グループは述べている。
▼関連リンク
・国立精神・神経医療研究センター プレスリリース




