CALM遺伝子変異、先天性QT延長症候群など重症遺伝性不整脈を引き起こす
京都大学は3月22日、カルモジュリン変異が致死性不整脈を引き起こすメカニズムに関して、患者iPS細胞由来の心筋細胞モデルを用いて明らかにしたと発表した。この研究は、同大大学院医学研究科地域医療システム学・循環器内科学の牧山武特定講師、高景山博士課程学生、山本雄大研究員(現:スタンフォード大学ポスドク)、順天堂大学医学部薬理学講座の小林琢也助教、呉林なごみ客員准教授、村山尚先任准教授らの研究グループによるもの。研究成果は、「Circulation: Arrhythmia and Electrophysiology」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
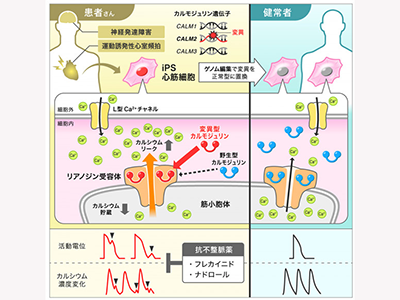
カルモジュリンは、真核細胞に普遍的に発現しており、カルシウムイオンのセンサーとしてさまざまなタンパク質と相互作用することによりその機能を調節している。カルモジュリン遺伝子は3つあり(CALM1-3)、いずれも同じアミノ酸配列をコードしている。近年、これらCALM遺伝子の変異が、先天性QT延長症候群やカテコラミン誘発性多形性心室頻拍(CPVT)など重症な遺伝性不整脈疾患を引き起こすことが報告され、カルモジュリン関連不整脈疾患「カルモジュリノパチー」として注目されている。ヒト心筋細胞においてCALM遺伝子変異が致死性不整脈を引き起こすメカニズムに関してはまだ十分に解明されていない。そこで、研究グループは疾患iPS細胞モデルを用いた研究を計画した。
患者iPS細胞由来の心筋細胞モデルでCPVTの特徴を再現
運動時に心室頻拍にて失神を来たしたCPVT症例において遺伝子解析を行い、血縁関係のない2症例においてCALM2遺伝子に同じヘテロ接合性ミスセンス変異(E46K)を検出した。患者末梢血よりiPS細胞を樹立。コントロールのiPS細胞としては、健常人由来株とゲノム編集により患者由来iPS細胞の変異を修復した株(アイソジェニックコントロール)を用いた。iPS細胞を心筋細胞へ分化させて、電気生理学的解析を行い、患者由来心筋細胞では、筋小胞体から細胞質へのカルシウムリークにより異常な電気的興奮やカルシウム動態異常が認められ、CPVTの特徴を再現していた。
抗不整脈薬、患者iPS細胞由来心筋細胞で抗不整脈効果を示す
カルモジュリンは、通常、筋小胞体から細胞質へカルシウムイオンを放出するリアノジン受容体(RyR2)の機能を抑制する生理的な働きがある。生化学的解析により、変異型カルモジュリンは、野生型カルモジュリンと比べてRyR2に優先的に結合し、逆に筋小胞体からのカルシウムリークを促進していることが判明。CALM遺伝子変異が重症不整脈を引き起こす仕組みが明らかとなった。さらに、臨床で使用される抗不整脈薬(ナドロール、フレカイニド)が、患者iPS細胞由来心筋細胞において抗不整脈効果を示した。
カルモジュリン変異、中枢神経系に影響を与えることも示唆
今回の研究は、カルモジュリン関連CPVTに関する初めての疾患iPS細胞モデルの報告であり、疾患発症機序や抗不整脈薬の薬効に関する知見は、実際の患者診療や原因遺伝子に応じた精密医療「プレシジョン・メディシン」の開発に大きく貢献すると考えられるという。また、同遺伝子変異を持つ2症例は、重症不整脈に加えて神経発達障害も有している。そのため、カルモジュリン変異が中枢神経系にも影響を与えることが示唆される。今後、新規治療法の開発、神経細胞における解析など患者診療への還元を目指して研究を進めていく、と研究グループは述べている。
▼関連リンク
・京都大学 最新の研究成果を知る



