超急性期・脳梗塞病変部への薬剤送達は困難、脂質結合型DNA/RNAヘテロ2本鎖核酸を検証
東京医科歯科大学は3月6日、脳梗塞においてLong non coding RNAを標的とした従来のアンチセンス核酸医薬の効果を飛躍的に向上する治療法の開発に成功したと発表した。この研究は、同大大学院医歯学総合研究科脳神経病態学分野(脳神経内科)の横田隆徳教授、石橋哲准教授、リ・フエイ研究員、市野瀬慶子大学院生、統合教育機構イノベーション人材育成部門の茂櫛薫特任教授、武田薬品工業株式会社ほかの研究グループによるもの。研究成果は、「Molecular Therapy」オンライン版に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
脳梗塞発症後は、脳神経細胞が不可逆的なダメージに至る前の超急性期に有効な治療を行うことが重要だ。しかし、血栓溶解療法などの現行の治療の恩恵を受けられる患者はごく一部に限られており、さらなる治療選択肢が期待されている。また、超急性期の脳梗塞病変部は脳血管関門(BBB)によるバリア機能が保たれていたり血管閉塞に伴い脳血流が極端に低下していたりすることから、病変部へ薬剤を到達させることが困難だ。このため、脳梗塞治療の標的となる遺伝子は解明されつつあるものの有効な治療が実現出来ていない。
研究グループは先行研究により、従来のRNAを標的とした1本鎖アンチセンス核酸の効果を大幅に向上できるDNA/RNAヘテロ2本鎖核酸を開発。DNA/RNAヘテロ2本鎖核酸を脳梗塞病巣部位に送達し、標的遺伝子を制御できれば脳梗塞の病態を改善させることが可能だ。研究グループは、さらに、脳梗塞超急性期における病変部位で脂質受容体の発現が増加し、虚血部位への物質送達に関与していることを発見。そこで、DNA/RNAヘテロ2本鎖核酸に脂質リガンドを結合することで、薬剤が脂質受容体を介して血液中から脳実質内へ細胞内輸送されることが可能だという仮説を立て、今回検証を行った。
従来のアンチセンス核酸と比べて、病巣への薬剤送達・遺伝子抑制効果が向上
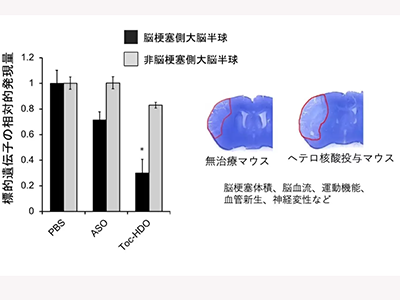
脳動脈永久閉塞モデルのマウスに対して、脂質リガンド結合DNA/RNAヘテロ2本鎖核酸を脳梗塞超急性期に経静脈的に投与。その結果、従来のアンチセンス核酸と比較して脳梗塞病変で飛躍的な標的遺伝子抑制効果を得られることが確認できた。また、脂質リガンドのうち、ビタミンEをリガンドに用いたDNA/RNAヘテロ2本鎖核酸では、特に脳梗塞病変部の血管や脳神経細胞に集中して薬剤が送達され、病変部位選択的に優れた標的遺伝子抑制効果を示すことを発見した。
マウスモデルで脳梗塞に伴う神経症状なども改善、臓器障害は認められず
続いて、ビタミンE結合DNA/RNAヘテロ2本鎖核酸を投与した脳梗塞マウスでは、脳梗塞に伴う神経症状や、脳梗塞のサイズ、血管の再生なども有意に変化し、有効な治療効果が得られることも確認。この薬剤の送達や遺伝子抑制効果には、脳梗塞部位での脂質受容体の発現の亢進が関与していることも確認したとしている。
近年、核酸医薬で臓器障害などの副作用が問題となっている。ビタミンE結合DNA/RNAヘテロ2本鎖核酸は、脳梗塞マウスに投与しても肝臓や腎臓への障害は認められなかったという。
脳梗塞急性期治療での薬剤送達課題を克服、遺伝子制御ツールとして臨床応用に期待
今回、脳梗塞急性期に、脂質リガンド結合HDOを経静脈的に投与することで、脳梗塞病変に選択的に薬剤が送達され、高い遺伝子抑制効果並びに治療効果を示すことが確認できた。DNA/RNAヘテロ2本鎖核酸技術は脳梗塞急性期治療における薬剤送達の課題を克服し得た、遺伝子制御ツールとして臨床応用されることが期待される。核酸医薬は脊髄筋萎縮症などに実際臨床応用され始めているが、薬剤の投与方法は髄腔内への直接投与だ。脳梗塞急性期の患者では、プラスミノーゲンアクチベーターや抗血小板薬など血液を固まりにくくする薬の投与をする場合が多く、髄腔内投与は出血のリスクが高まる。脂質リガンド結合DNA/RNAヘテロ2本鎖核酸は、経静脈的投与により投与が可能であることは合併症予防の観点からも非常に優れていると言える、と研究グループは述べている。
▼関連リンク
・東京医科歯科大学 プレスリリース




