T細胞による腫瘍殺傷が選択圧として作用し、免疫回避のMHC-I欠損がん細胞が増加
京都大学は2月24日、T細胞からのサイトカインに対する感受性を高めることが難治性がんに対する新規治療戦略となりうることを明らかにしたと発表した。この研究は、同大医生物学研究所の伊藤能永教授、ハーバード大学メディカルスクール(Harvard Medical School)のKai Wucherpfennig教授らの研究グループによるもの。研究成果は、「Cancer Discovery」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
がん組織には、単一患者由来のものであっても、遺伝的、あるいは非遺伝的な違いを有する多様ながん細胞が含まれている(腫瘍の不均一性)。このことは、治療に対する抵抗性の主な原因の一つである。すなわち、遺伝的不安定性などにより生み出された多様ながん細胞を含むがん組織に対して治療を行うと、多くの場合治療が強力な選択圧となって抵抗性がん細胞の割合が増加し、がん組織内で大半を占めるようになる。
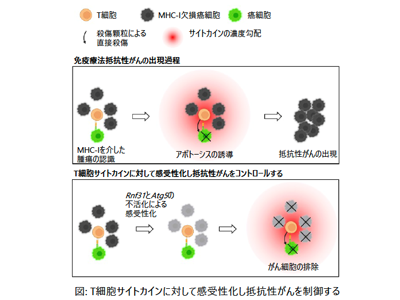
T細胞は腫瘍を殺傷する機能を持ち、がん免疫療法では中心的な役割を担う。T細胞は、がん細胞表面上のMHC-I分子によって提示されたがんペプチドを認識してT細胞受容体を活性化し、パーフォリンやグランザイムを含む細胞殺傷顆粒をがん細胞に向けて放出することでがん細胞を殺傷する。T細胞による腫瘍殺傷は、がん組織に対しては強力な選択圧として作用し、その結果MHC-I発現を低下あるいは失ったがん細胞の増加を引き起こす。実際さまざまながんでMHC-Iの消失が報告されている。細胞殺傷性CD8 T細胞の、T細胞受容体を介した腫瘍細胞の認識はMHC-I分子に依存しているため、このようなMHC-I欠損がん細胞はT細胞には検知されない。このようにMHC-I欠損がんはT細胞による免疫反応を逃れる代表的な抵抗性がんである。今回の研究では、MHC-I欠損がん細胞を活性化T細胞の標的に変えうるような分子標的を明らかにすることを目的とした。
TNFシグナル経路とオートファジー関連遺伝子がMHC-I欠損がん細胞の抵抗性に関連
感受性がん細胞と抵抗性がん細胞が混在したがん組織のモデルとして、T細胞標的抗原であるOVAを発現したがん細胞と、MHC-I欠損がん細胞の共培養系を用意した。MHC-I欠損がん細胞(Cas9タンパク質を強制発現)にゲノムワイドのガイドRNAライブラリーを導入しておき、OVA特異的活性化T細胞を共培養系に加えた。その結果、T細胞標的抗原OVA発現がん細胞はOVA特異的T細胞によって認識されパーフォリンやグランザイムにより殺傷される。T細胞は周囲に大量のサイトカイン(IFNγやTNFα)を放出し、周囲に炎症環境を作り出す。周囲に存在するMHC-I欠損がん細胞はT細胞には認識されないが、炎症環境に対する感受性の違いによって数が増減する。このようなゲノムワイドCRISPRスクリーニングによって、MHC-I欠損がん細胞の抵抗性に関連する遺伝子を明らかにした。その結果、TNFシグナル経路とオートファジーにそれぞれ関わる遺伝子が見つかってきた。
Rnf31+Atg5欠損で、MHC-I欠損がん細胞はT細胞由来サイトカインによるアポトーシスで死滅
実際にRnf31遺伝子(TNFシグナル経路)とAtg5遺伝子(オートファジー関連遺伝子)を遺伝子ノックアウトにより不活化すると、MHC-I欠損がん細胞がT細胞由来サイトカイン(IFNγとTNFα)に対して感受性化しアポトーシスによって死滅することを見出した。次にその分子機序の解明を試みた。オートファジーは、アポトーシスの機能分子であるCaspase8を分解しており、そのためオートファジーを阻害することで、腫瘍細胞内でサイトカインによるアポトーシス誘導が増強されることがわかった。またRNF31分子は、TNFシグナルを受けた細胞が生きるか、アポトーシスで死ぬかを決定するスイッチとして機能することがわかっている。実際にRnf31を失活させるとMHC-I欠損がん細胞はTNFシグナルによってCaspase8依存性の細胞死を起こした。
さらに、Rnf31遺伝子とAtg5遺伝子の両者を欠損させると、Caspase8の増加による相乗的なアポトーシス誘導効果があることが判明。このようにしてアポトーシスに陥ったMHC-I欠損がん細胞は、樹状細胞によってT細胞に対して効率よく交差提示され腫瘍に特異的なT細胞を活性化、結果として腫瘍に浸潤するIFNγあるいはTNFα産生T細胞数を増加させることがわかった。このように、抵抗性がん細胞内のTNFシグナル経路とオートファジーを不活性化することで、T細胞由来のIFNγやTNFαによるMHC-I欠損がん細胞のアポトーシス誘導、アポトーシス細胞のクロスプレゼンテーション増強、IFNγ+TNFα産生T細胞のさらなる腫瘍浸潤という、フィードフォワードループが形成されることがわかった。さらにマウスモデルを用いて、TNFシグナル経路とオートファジー双方を薬物あるいは遺伝子操作により阻害することで、MHC-I欠損がん細胞を有するがんをコントロールできることを明らかにした。
MHC-I欠損がん細胞による治療抵抗性がんを抑える新たな治療戦略となりうる
今回の研究では、治療抵抗性の原因の一つである腫瘍の不均一性に着目し、そこに含まれる抵抗性がん細胞のTNFシグナル経路とオートファジーを標的として不活性化することが、新たな治療戦略となりうることを示した。「例えば、免疫チェックポイント阻害剤による治療を行う際に両経路に対する薬剤を併用すれば、MHC-I欠損がん細胞の増加による治療抵抗性がんの出現を抑えることができる可能性がある」と、研究グループは述べている。
▼関連リンク
・京都大学 最新の研究成果を知る




