重症心不全のベッカー型筋ジストロフィー女性キャリア症例、iPS細胞由来分化心筋細胞で解析
大阪大学は2月13日、ベッカー型筋ジストロフィーが重症心不全をきたすメカニズムを、iPS細胞由来分化心筋細胞を用いて解明したと発表した。この研究は、同大大学院医学系研究科の肥後修一朗特任准教授(重症心不全内科治療学共同研究講座)、坂田泰史教授(循環器内科学)らの研究グループによるもの。研究成果は、「JACC:Basic to Translational Science」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
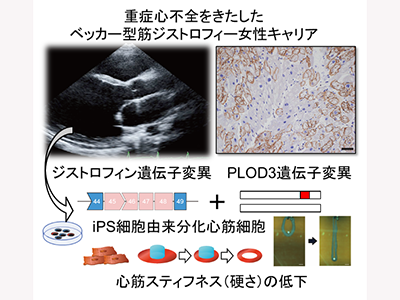
現在の日本において、心臓移植が必要な重症心不全の原因の多くを拡張型心筋症が占めている。ベッカー型筋ジストロフィーは、ジストロフィン遺伝子の変異により発症する遺伝性の病気で、心不全の原因となる拡張型心筋症の原因となる。ジストロフィン遺伝子はX染色体上に存在するため、X染色体を1本しかもたない男性で発症することが多く、X染色体を2本もつ女性はキャリアとなり、男性に比べ軽症で経過することが多いとされている。ベッカー型筋ジストロフィー女性キャリアが、若くして重症心不全に至ることは極めてまれであり、その原因やメカニズムは明らかではなかった。
今回、研究グループは、若くして補助人工心臓が必要な重症心不全に至ったベッカー型筋ジストロフィー女性キャリア症例を見出し、心筋組織病理解析、遺伝解析、iPS細胞由来分化心筋細胞を用いた機能解析を実施した。
ジストロフィン遺伝子変異に加え、PLOD3遺伝子にストップゲイン変異
本症例では、ジストロフィン遺伝子の45番目から48番目のエクソンが抜け落ちる遺伝子変異により、短くなったジストロフィン(Δ45-48ジストロフィン)がつくられていることがわかった。ベッカー型筋ジストロフィー女性キャリアでは、X染色体不活化により、全身の組織で正常なジストロフィンと短くなったジストロフィンがモザイク状に存在している。しかし、ヒト心臓の組織で同様の現象が起きているかは、明らかではなかった。補助人工心臓手術時に得られた心筋組織を対象に、エクソン45を認識する抗体で免疫染色を行ったところ、正常ジストロフィンとΔ45-48ジストロフィンがおよそ6:4の比率で作られていることが明らかとなった。
続いて、本症例の重症化メカニズムを明らかにするため、詳しく遺伝子解析を実施。その結果、ジストロフィン遺伝子変異に加え、PLOD3遺伝子にストップゲイン変異が生じていることが明らかとなった。ベッカー型筋ジストロフィー女性キャリアでは、全身の細胞において、2本のX染色体がランダムにX染色体不活化を受けている。研究グループは、このX染色体不活化のしくみを利用することで、血液の細胞から作製したiPS細胞から、正常なジストロフィンまたはΔ45-48ジストロフィンを主に作り出しているiPS細胞を選別することに成功した。
PLOD3変異、心筋スティフネス低下・コラーゲン産生量低下に関与
さらに、ゲノム編集技術を用いて、同定されたPLOD3遺伝子変異を正常に修復した遺伝背景が同一のアイソジェニックiPS細胞を作製。これら細胞は同一の遺伝背景を持つため、病気の原因となる遺伝子の機能に焦点をあてた解析が可能となる。
作製したiPS細胞を心筋細胞に分化させ、更にリング状に組織化し、上下に伸ばす刺激を加えることで、心筋組織が収縮する力やスティフネス(硬さ)を測定。Δ45-48ジストロフィンを作り出す心筋細胞では、正常ジストロフィンを作り出す心筋細胞に比べて収縮力、スティフネスが低下し、PLOD3変異を修復することで、スティフネスが改善することが明らかとなった。また、組織の維持に必要なコラーゲンの産生量がPLOD3の欠損により低下し、ゲノム編集で変異を修復することで改善することが明らかとなった。
重症症例への治療法開発に期待
本症例では、ベッカー型筋ジストロフィーの原因となるジストロフィン遺伝子に加え、2つ目のPLOD3遺伝子変異が存在することで、特に心筋のスティフネス(硬さ)に影響し、重症化に関わっていることが示唆された。同研究成果により、これら重症症例に対する今後の治療法開発につながると考えられる、と研究グループは述べている。
▼関連リンク
・大阪大学 ResOU



