肉芽腫内部のような炎症抑制性環境が誘導されるメカニズムの詳細はほとんど不明
京都大学は2月17日、モルモット肉芽腫モデルを活用して、炎症抑制性M2マクロファージの肉芽腫分布を特定するとともに、S100A9分子を高発現する活性化好中球がM2マクロファージと隣接して存在することを発見、S100A9ノックアウトマウスを用いた分子細胞生物学実験を通して、好中球S100A9を介したM2マクロファージ誘導機序の解明に成功したと発表した。この研究は、同大学医生物学研究所の水谷龍明助教、杉田昌彦教授らの研究グループによるもの。研究成果は、「iScience」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
結核などの慢性感染病態においては、病原体と宿主免疫系の攻防の結果、マクロファージが同心円状に密に配置された球状の細胞集塊(肉芽腫)が形成される。肉芽腫は、異物や病原菌を排除するための強力な炎症反応だが、その内部に炎症を抑えている特殊な環境が存在することが知られている。こうした炎症抑制性環境は、病原菌の長期生存を許す温床となってしまう。炎症抑制性環境が誘導されるメカニズムは慢性感染病態の理解や制御に不可欠だが、その詳細はほとんど不明だった。
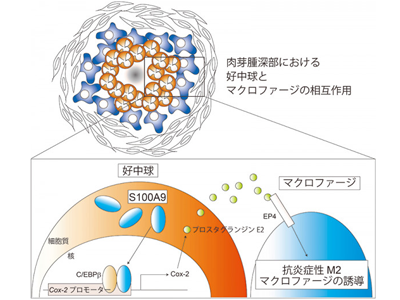
モルモット肉芽腫、M2マクロファージとS100A9を高発現する活性化好中球が隣接
肉芽腫の炎症抑制環境の主体は、M2極性を示すマクロファージであることが推察されていた。研究チームは、ヒト結核肉芽腫と高い相同性を持つ、モルモット肉芽腫モデルを構築し、その病理解析を行った。その結果、肉芽腫中心部にアルギナーゼ1を発現するM2マクロファージとS100A9を高発現する活性化好中球が隣接して存在することがわかった。S100A9分子は、細胞が障害を受けた際、細胞外に放出されて周りの細胞に働きかけるダメージ関連分子パターン(DAMPs)に分類されており、炎症制御系の多岐にわたって影響を及ぼす分子である。そこで、M2マクロファージ誘導におけるS100A9の影響を調べるため、S100A9ノックアウトマウス(A9KO)を作出し、S100A9によるM2誘導効果を調べた。結核菌アナログであるBCGを野生型とA9KOマウスに接種したところ、A9KO個体では、M2マクロファージが顕著に減少することがわかった。また、BCG投与後の活性化好中球と未刺激のマクロファージを混合した共培養in vitro実験を行ったところ、A9KO好中球によるマクロファージM2誘導能が顕著に障害されることを明らかにした。
S100A9は、転写補因子のようにCox-2発現を亢進させM2マクロファージを誘導
ついで、M2マクロファージの誘導に関わるS100A9シグナルの分子基盤を解明すべく、好中球のRNA-seqを行ったところ、プロスタグランジン合成酵素であるシクロオキシゲナーゼ2(Cox-2)が、S100A9に依存して発現することを突き止めた。S100A9は、従来のDAMPsの作用とは異なり、核内において転写補因子のような働きをすることで、Cox-2発現を亢進させる働きがあることがわかった。好中球におけるCox-2発現亢進は、プロスタグランジンE2の産生を促し、隣接するマクロファージのプロスタグランジン受容体(EP4)に作用し、M2極性を付与することがわかった。最終的には、Cox-2に対する特異的阻害剤(セレニシコブ)をモルモット肉芽腫モデルに投与することで、肉芽腫深部のM2マクロファージが顕著に阻害されることがわかり、S100A9-Cox-2経路がM2マクロファージの誘導に重要な役割を持つことが明らかになった。今回明らかとなった好中球におけるS100A9-Cox-2経路は、M2マクロファージの新たな誘導経路の発見のみならず、結核病態を理解する重要な知見になると考えている。
結核慢性感染に対する新たな治療開発の基盤的成果
今回の研究成果は、結核慢性感染を制御する新たな治療開発に向けた基盤的成果になるものと考えているが、マウスやモルモットといった実験動物から得られた結果であり、ヒトで同様の現象が生じるのかを明らかにすることが重要である。「好中球が発現するS100A9は、がんの慢性炎症病態の理解と制御に向けた重要なカギとなる可能性があるため、悪性腫瘍を題材とした発展的研究も進めている」と、研究グループは述べている。
▼関連リンク
・京都大学 最新の研究成果を知る




