セレコキシブによるがん細胞死、分子機構は未解明だった
東京工科大学は2月1日、痛み止め市販薬である「セレコキシブ」のミトコンドリアを介した新たな抗がん性の作用機構を発見したと発表した。この研究は、同大大学院バイオ・情報メディア研究科の丸山竜人助教、杉山友康教授らの研究グループによるもの。研究成果は、「Naunyn-Schmiedeberg’s Archives of Pharmacology」オンライン版に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
セレコキシブは、シクロオキシゲナーゼ(COX-2)を選択的に阻害する非ステロイド抗炎症薬(NSAIDs)で、ロキソプロフェンやアセトアミノフェンとともに代表的な痛み止め市販薬として知られている。一方、セレコキシブは抗がん作用を有することも注目されているが、その分子機構については十分に解明されていなかった。セレコキシブは、小胞体内のカルシウムイオンを枯渇させ、小胞体に過剰なストレスを与えることで、細胞が生体の恒常性を保つために細胞死を誘導する。
研究グループは今回、この細胞死において重要な役割を担う細胞小器官のミトコンドリアを介した誘導機構の解明に取り組んだ。
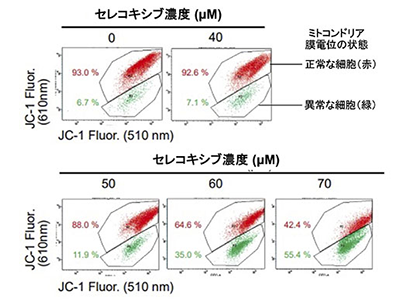
ヒト大腸がん細胞株、セレコキシブ濃度依存的にミトコンドリア膜電位消失
研究では、ミトコンドリアの状態を把握するための指標として「ミトコンドリア膜電位」を用いた。ヒト大腸がん細胞株HCT116にセレコキシブを複数の濃度条件で処理したところ、セレコキシブの処理濃度依存的にミトコンドリア膜電位が消失した。同消失は、ミトコンドリア生合成に異常が生じると引き起こされるという。
膜電位消失の一因として、ミトコンドリア生合成遺伝子の発現低下が関与
次に、ミトコンドリア生合成に関連する遺伝子の発現量にセレコキシブが与える影響を検証したところ、セレコキシブの処理により、それら遺伝子の発現量は低下していた。これらのことから、セレコキシブによるミトコンドリア膜電位の消失の一因として、ミトコンドリア生合成遺伝子の発現低下が関与していることが示唆された。
セレコキシブによりTMEM117発現が減少し、ミトコンドリア生合成遺伝子の発現が低下
同研究室ではこれまでに、ミトコンドリア膜電位の消失を介した細胞死を誘導するshRNA配列を取得し、その標的遺伝子として「TMEM117」を同定している。そこで、この発現量への影響を調べた結果、セレコキシブの処理によりTMEM117の発現量は減少した。また、ミトコンドリア生合成に関連する遺伝子の発現量は、TMEM117遺伝子の発現を抑制した場合でも低下した。
以上の結果から、セレコキシブによるミトコンドリア膜電位の消失は、TMEM117の発現低下を介したミトコンドリア生合成に重要な遺伝子の発現抑制によって引き起こされることが示唆された。
セレコキシブを利用した新規がん治療戦略の開発に期待
今回の研究により、COX-2を発現していないがん細胞株に対して、セレコキシブはがん細胞死の初期にみられるミトコンドリア膜電位の消失を引き起こすことが示された。これはCOX-2選択的阻害剤として使用する一般的な濃度と比べ、高い濃度で作用させた時に見られた現象だ。高濃度セレコキシブには抗がん作用があることが知られているが、同研究成果はCOX-2を標的としない新たな作用経路を発見したと言える。
「がん細胞におけるミトコンドリアの不安定化はがん治療に効果的であるため、セレコキシブを利用した新たながん治療の戦略開発などへの応用が期待される」と、研究グループは述べている。
▼関連リンク
・東京工科大学 プレスリリース




