顎顔面形成の異常に関わるエンドセリンA受容体の変異、発症メカニズムの詳細は未解明
東京大学は1月14日、原子のレベルから顎顔面骨形成不全症を示すエンドセリンA受容体(Gタンパク質共役受容体;GPCRの1つ)変異の発症機序を解明したと発表した。この研究は、同大大学院医学系研究科代謝生理化学分野の栗原由紀子講師、INSERM(フランス国立衛生医学研究所)、横浜市立大学大学院生命医科学研究科らの研究グループによるもの。研究成果は、「Journal of Clinical Investigation」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
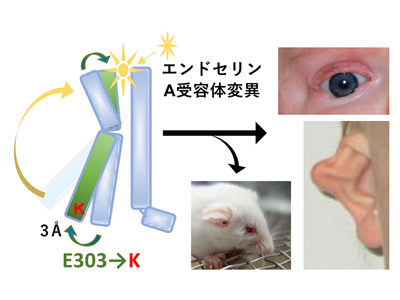
特定の遺伝子異常が原因の希少疾患はいろいろ知られているが、その発症メカニズムの多くは解明されていない。研究グループはこれまで、エンドセリン1やエンドセリンA受容体(ETAR)の遺伝子改変マウスにより、エンドセリン1ーエンドセリンA受容体シグナルが頭部神経堤細胞に作用して、頭部顔面や心臓大血管の形成に重要であること、特に顎顔面形成においては、エンドセリンシグナルが核転写因子Dlx5/6の誘導を介して上顎下顎を決定することを明らかにしてきた。一方、パリのネッカー小児病院の研究グループは、耳介、顔面の形態異常や難聴を示す「脱毛症を伴う顎顔面骨形成不全症」の症例の中に、エンドセリンA受容体の1塩基変異:G→A、アミノ酸ではグルタミン酸からリジンへの変異(E303K)があることを次世代シークエンサー等で見出した。
E303K・Y129Fの1アミノ酸変異を持つマウス、どちらもヒト症例を模倣
研究グループは、本当にこれらの1アミノ酸変異が発症の原因であるかを確かめるために、ヒトと全く同じ1アミノ酸変異だけを持つマウスをCRISPR/CASを用いて作製したところ、耳介の形態異常、上顎骨の形態異常、難聴を推測させる耳小骨の低形成が再現された。同時に、研究グループが以前報告したエンドセリンA受容体Y129F変異(チロシンからフェニルアラニンへの変異)症例のモデルマウスも、ヒト症例を模倣しかつE303K変異マウスとほぼ同様の表現型を示した。
エンドセリンA受容体の1アミノ酸変異、胎生期に起こらないエンドセリン-3との結合を可能に
この上顎骨の異常は、エンドセリンシグナルを異所性に上顎に発現させたマウスの上顎骨に似ていることから、エンドセリンシグナルの機能獲得変異である可能性を考えた。胎生期の将来上顎になる鰓弓部分にはもともとエンドセリン-3が発現しているが、エンドセリン3は生体ではエンドセリンA受容体にほとんど結合しない。そこで、「エンドセリンA受容体の変異によってエンドセリン-3と結合するようになった」と仮説を立てた。この仮説は、CRISPR/CASで作製したエンドセリン-3ノックアウトによって表現型が正常に戻ったことと、培養細胞の系でE303K変異またはY129F変異のエンドセリンA受容体が、エンドセリン-3との親和性を獲得し受容体の下流シグナルが上昇したことから証明された。
MDシミュレーションによりタンパク質分子内のオングストロームレベルの動きを可視化
では、リガンド結合部位のから離れたところにあるE303K、Y129F変異はどのようにしてエンドセリン-3の親和性を増加させたのか。E303Kでは、グルタミン酸からリジンへの変異によってアミノ酸側鎖の電荷がマイナスからプラスへと性質を大きく変えているため、周囲とのイオン結合や水素結合が変化することが想定された。そこでエンドセリンA受容体のモデリングを施行後MD(分子動力学)シミュレーションを導入した。MDシミュレーションは、タンパク質を形成する原子1つ1つに対して加わる力に基づいてニュートンの運動方程式を立てて、すべての原子に加わる力を一度にスーパーコンピューターで計算することにより、タンパク質分子内のオングストロームレベルの動きを可視化する。1ナノ秒ごとに原子の3次元位置座標が得られるので、E303のアミノ酸側鎖がどの原子とどの程度結合するかや、ヘリックスがどのくらい動くかを確率論的に計算できる。
変異により受容体とリガンドの親和性が高まる仕組みを明らかに
MDシミュレーションにより、ヘリックスの細胞内側に位置するE303Kは隣のヘリックスと結合できなくなって大きく動くようになり、その分細胞外側は狭まる確率が高くなった。これにより、エンドセリン-3とエンドセリンA受容体は結合すると乖離しにくくなり、親和性が上昇すると考えられる。即ち、「ET-3+ETAR⇄ET-3/ETAR」の平衡が右に大きく傾くということである。同様に計算すると、受容体の中心部のナトリウム-水ポケットに位置するY129F変異では、フェニルアラニンはチロシンのOH基がHに置き換わったものであるため、周囲の水分子との水素結合がなくなり、水ポケットが小さくなるのに合わせてリガンド結合部位が狭くなる確率が高くなり、E303Kと同様にエンドセリン-3に対する親和性が上昇したと考えられた。エンドセリン受容体はアドレナリン受容体やオピオイド受容体などと同じクラスAGPCRであり、細胞内側のヘリックスの動きやナトリウム-水ポケットについては共通していると考えられるので、GPCRシグナル伝達の研究やGPCRをターゲットとした創薬において重要な知見を与えたと言える。
多くのGPCRの活性化に共通するメカニズムである可能性
今回研究グループは、先天性希少疾患である「脱毛症を伴う顎顔面骨形成不全症」を示すエンドセリンA受容体変異症例の発症メカニズムを、モデルマウス、薬理実験、MDシミュレーションを駆使して解明した。受容体の1アミノ酸変異によって、生体において正常ではほとんど結合しないリガンドが強く結合することでヒトの症状が発症することを証明した。そしてそのメカニズムが、リガンド結合部位から離れている変異がアロステリックにリガンド結合に影響を与え、リガンドの乖離を阻害し結合性を増加させることを明らかにした。「解明したエンドセリンA受容体変異の発症機構は、多くのGPCRの活性化に共通するメカニズムと考えられる。すなわち、細胞のシグナル伝達を担う主要な受容体であるGPCRは薬のターゲットの3分の1以上を占めていることから、GPCR活性化機序を詳細に明らかにしたことは創薬のデザインにも大きく貢献すると考えられる」と、研究グループは述べている。
▼関連リンク
・東京大学 プレスリリース



