MBNL1の機能阻害によるスプライシング異常を再現したヒト細胞評価系の開発が必要
京都大学iPS細胞研究所(CiRA)は1月11日、筋強直性ジストロフィー1型(DM1)患者由来のiPS細胞から作製した骨格筋細胞を用いて、DM1の主要な病態である細胞核内におけるMBNL1タンパク質の凝集および遺伝子スプライシング異常を再現し、定量的な薬効評価の可能なDM1のヒト細胞病態モデルを構築することに成功したと発表した。この研究は、同研究所臨床応用研究部門の川田竜共同研究員(現 大正製薬株式会社Discovery研究所)、櫻井英俊准教授らの研究グループによるもの。研究成果は、「Scientific Reports」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
DM1は成人において最も頻度の高い筋ジストロフィーとされているが、根本的な治療薬は存在していない。治療薬の探索、開発を行うためには、DM1患者で認められる病態を再現したヒト細胞評価系の開発が求められている。DM1は、常染色体優性遺伝形式をとる遺伝性疾患であり、DMPK(dystrophia myotonica-protein kinase)遺伝子のCTG繰り返し配列が異常に伸長することが原因とされている。変異したDMPK遺伝子から産生される異常RNAは、遺伝子スプライシング機能を担うタンパク質MBNL1(muscleblind like splicing regulator 1)に結合することで、細胞核内で凝集体を形成する。その結果、MBNL1の正常な機能が阻害され、多くの遺伝子におけるスプライシング異常が生じることがDM1病態発症の主要な機序であるとされている。
そこで研究グループは、DM1患者由来のiPS細胞から、DM1の骨格筋における病態を再現する骨格筋細胞の分化誘導方法を特定し、治療薬による病態改善効果を定量的に調べることのできるヒト細胞評価系を開発することを目指して研究を行った。
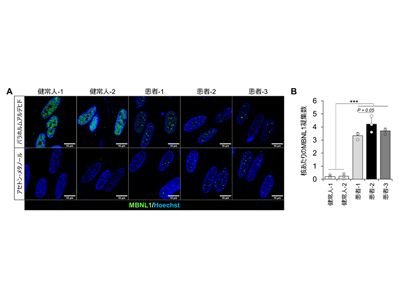
DM1患者由来iPS細胞から作製した骨格筋細胞において、MBNL1タンパク質の凝集を確認
研究グループは以前に、ヒトiPS細胞に骨格筋特異的転写因子MyoD1を強制発現させることで骨格筋細胞への分化誘導を行う方法を開発した。そこで、DM1患者と健常人から作製したiPS細胞に対して、MyoD1を強制発現させることで骨格筋細胞を作製した。その結果、10日間の培養によって分化したDM1患者由来の骨格筋細胞の核内において、MBNL1タンパク質が凝集することを確認した。また、細胞の状態を固定する方法を検討し、アセトン-メタノールを用いた固定法を用いることで、凝集したMBNL1タンパク質のみを特異的に検出し、画像解析によるMBNL1凝集数の定量評価が可能となった。本手法を用いることで、3名のDM1患者由来の骨格筋細胞において核あたりのMBNL1凝集数が増加することを確認し、定量的なMBNL1核内凝集評価系を構築することに成功した。
培養方法を変更し、分化させた細胞において遺伝子スプライシング異常の再現を確認
次に、DM1患者由来iPS細胞から誘導した骨格筋細胞において遺伝子のスプライシング異常が再現されるかを調べた。しかしながら、DM1患者でスプライシング異常が認められる代表的な遺伝子であるDMDおよびBIN1について、10日間の分化培養では骨格筋細胞の成熟度が低かったため、その異常を検出することが難しいことがわかった。
そこで、培養方法を検討し、新たな分化誘導方法を開発した。新たに開発した培養方法を用いて分化した骨格筋細胞から、遺伝子を抽出および精製し、定量的リアルタイムPCR法による遺伝子スプライシング評価を行った。その結果、17日間の培養により分化したDM1患者由来の骨格筋細胞において、成人型遺伝子の指標である「DMD exon 78」および「BIN1 exon 11」挿入遺伝子の発現量が低く、遺伝子スプライシング異常が生じていることを確認した。これらの結果から、17日間の分化誘導方法により、遺伝子スプライシング異常の定量的な評価系を構築することに成功した。
アンチセンス核酸CAG25の薬効試験に成功
続いて、MBNL1タンパク質核内凝集および遺伝子スプライシング異常を再現した評価系に対して、実験的にDM1への有効性が認められているアンチセンス核酸CAG25を処置する薬効の評価試験を行った。その結果、DM1患者由来の骨格筋細胞において、アンチセンス核酸処置により、MBNL1核内凝集数が減少し、遺伝子スプライシング異常が改善することを確認した。したがって、これらのDM1病態評価系を薬効評価に用いることの妥当性を確認することができた。
別の手法でより成熟した骨格筋細胞の作製に成功、SERCA1のスプライシング異常を検出
最後に、筋力を発揮するために重要な役割を果たす細胞内カルシウム制御分子SERCA1(遺伝子名:ATP2A1)遺伝子のスプライシング異常が再現されるかを調べた。しかし、MyoD1を強制発現する分化誘導法では、骨格筋細胞の成熟度が低く、病態を再現することができなかった。そこで、以前に研究グループが開発した、遺伝子導入を行わない分化誘導方法でヒトiPS細胞から骨格筋幹細胞を誘導し、より成熟した骨格筋細胞を作製する検討を行った。
骨格筋幹細胞から分化誘導した骨格筋細胞は、MyoD1を強制発現した骨格筋細胞に比較して成熟度が高く、DM1患者由来の骨格筋細胞においてSERCA1遺伝子のスプライシング異常を検出することに成功した。また、アンチセンス核酸CAG25処置により、スプライシング異常が改善したことから、SERCA1遺伝子のスプライシング異常を指標とした薬効評価系を構築することに成功した。
根本的な治療薬がないDM1、治療薬開発への貢献が期待
今回の研究では、DM1患者由来のiPS細胞から骨格筋細胞の分化誘導方法を検討することで、DM1患者の骨格筋において確認されるMBNL1タンパク質の核内凝集および遺伝子スプライシング異常の再現に成功し、ヒト細胞による定量的な評価系を構築した。
短期間で評価可能なMyoD強制発現細胞による評価系はDM1の治療薬スクリーニングのための応用、成熟度が高く、筋力発現に重要なSERCA1遺伝子スプライシング異常の評価を可能にした骨格筋幹細胞を経由する評価系は、DM1治療薬の臨床における薬効予測精度向上のための応用がそれぞれ期待される。「根本的な治療薬が存在しないDM1に対する新規治療薬の開発が切望されている。今回新たに構築したDM1患者由来のヒトiPS細胞評価系を用いることで、DM1に有効な治療薬の探索と開発に貢献することが期待される」と、研究グループは述べている。
▼関連リンク
・京都大学iPS細胞研究所(CiRA) ニュース




