免疫抑制剤ミコフェノール酸、腎機能低下<血清アルブミン結合率低下による副作用が懸念
藤田医科大学は12月23日、ミコフェノール酸とヒト血清アルブミンとの相互作用解析を行い、ミコフェノール酸のヒト血清アルブミン中での正確な結合位置を解明したと発表した。この研究は、同大医学部微生物学講座の河合聡人講師、崇城大学薬学部薬物動態学研究室の山崎啓之教授らの研究グループによるもの。研究成果は、「Journal of Medicinal Chemistry」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
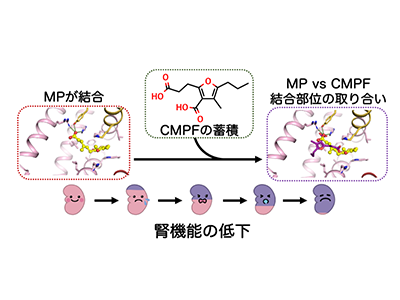
免疫抑制剤ミコフェノール酸モフェチルは、臓器移植後の拒絶反応の予防やループス腎炎の治療に用いられる薬だ。ミコフェノール酸モフェチルを服用すると、体内に吸収された後、薬効を示すミコフェノール酸に変換され血液を介して全身を巡る。血液中ではミコフェノール酸の97~99%が血漿タンパク質(特にヒト血清アルブミン)に結合していることが知られている。しかし、腎機能が低下すると、ミコフェノール酸のヒト血清アルブミンへの結合率も低下することが知られている。これが原因となり、ミコフェノール酸の副作用へとつながることが懸念されている。
ミコフェノール酸、ヒト血清アルブミンのサブドメインIIAに結合、正確な結合位置も決定
研究グループは、まず代表的な血漿タンパク質のヒト血清アルブミンとα1-酸性糖タンパク質の2種類に対するミコフェノール酸の結合の強さを平衡透析法により調べた。その結果、ヒト血清アルブミンへの親和性が1.96×105M-1、α1-酸性糖タンパク質への親和性が0.12×105M-1を示し、ヒト血清アルブミンへの結合親和性の方が10倍強いことが明らかになった。
次に、ヒト血清アルブミン中のどの部位に結合しているのかを解明するため、ヒト血清アルブミンのサイトマーカー物質(サブドメインIIA:ワルファリン、アセノクマロール、フェニルブタゾン;サブドメインIIIA:ジアゼパム、アリピプラゾール)を混ぜた時のミコフェノール酸の親和性の変化を計測。その結果、サブドメインIIIAのサイトマーカー物質であるジアゼパムやアリピプラゾールが存在している時のミコフェノール酸の親和性は変化しなかったが、サブドメインIIAのサイトマーカー物質であるワルファリン、アセノクマロール、フェニルブタゾンが存在すると、その量依存的にミコフェノール酸の親和性が弱くなっていくことがわかった。これはミコフェノール酸がヒト血清アルブミン中で結合部位を取り合っている状態で、ミコフェノール酸はヒト血清アルブミンのドメインIIAに結合することを示している。
さらに視覚的にミコフェノール酸とヒト血清アルブミンの結合状態を観察するため、ヒト血清アルブミンにミコフェノール酸が結合した状態の結晶を調製。その結晶を用いて、大型放射光実験施設高エネルギー加速器研究機構Photon FactoryでX線回折データを収集し、ヒト血清アルブミンとミコフェノール酸複合体の立体構造を解明した。この立体構造でもミコフェノール酸はヒト血清アルブミンのサブドメインIIAに1分子結合している様子が観察された。
さらに、ミコフェノール酸のイソベンゾフラン環がヒト血清アルブミンのTrp214とスタッキング相互作用し、ミコフェノール酸のカルボキシ基はヒト血清アルブミンのTyr150、His242、Arg257と水素結合を形成できる距離に存在していることが明らかになった。
尿毒症物質CMPF、ミコフェノール酸のヒト血清アルブミン結合を優位に邪魔する
最後に、腎機能の低下に伴い血液中に蓄積されることが知られている尿毒症物質(インドキシル硫酸、インドール酢酸、p-クレジル硫酸、CMPF)や脂肪酸(オレイン酸、ミリスチン酸)が共存した時のミコフェノール酸のヒト血清アルブミンに対する結合能の変化を調べた。その結果、CMPFが存在すると、ミコフェノール酸のヒト血清アルブミンへの結合能が著しく低下することが示された。その次に影響が観察されたのは脂肪酸で、脂肪酸はその量が増えてくるとCMPF同様に結合能の低下を引き起こすことが明らかになった。
この結果を踏まえ、ヒト血清アルブミンにミコフェノール酸が結合している構造とCMPFが結合している構造を重ね合わせてみると、両者の結合位置がぴったりと一致していることがわかり、両者が存在するとヒト血清アルブミン中での結合ポケットの取り合いをしていることが視覚的にも想定されたとしている。
今回の研究成果より、ミコフェノール酸のヒト血清アルブミンへの結合位置、その相互作用様式、結合の強さがわかった。そして、尿毒症物質CMPFがミコフェノール酸のヒト血清アルブミンへの結合を優位に邪魔することが明らかになった。これまでの研究で、CMPFはヒト血清アルブミンのドメインIIAに結合し、その親和性は130.5×105M-1であることが示されていて、ミコフェノール酸の約70倍強いことが知られている。つまり、このCMPFの血液中の濃度を指標にミコフェノール酸モフェチルの使用量を調節すれば、より安全に治療できることが期待される。
また、研究グループはミコフェノール酸の本来の標的であるイノシン脱水素酵素とミコフェノール酸の立体構造、今回解明したヒト血清アルブミンとミコフェノール酸の立体構造を見比べて、イノシン脱水素酵素の働きを止める作用には影響がなく、CMPFなどのヒト血清アルブミンのドメインIIAに結合する物質との椅子取りゲームに強くなる化合物のデザインを論文中に提案している。今後、この化合物が想定通りの効果を示すか検証することで、より安全な免疫抑制剤の開発へとつながることも期待される、と研究グループは述べている。
▼関連リンク
・藤田医科大学 プレスリリース




