動物実験段階で髄腔内投与の際に起こることがある副作用が開発の障害に
東京医科歯科大学は12月27日、脳や脊髄の疾患を標的とする核酸医薬の課題である副作用が、神経細胞内のカルシウム調節異常が原因であることを突き止めたと発表した。この研究は、同大大学院医歯学総合研究科脳神経病態学分野の横田隆徳教授、吉岡耕太郎特任助教、Su Su Lei Mon特任研究員、Chunyan Jia大学院生らの研究グループによるもの。研究成果は、「Molecular Therapy-Nucleic Acids」オンライン版に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
核酸医薬は、抗体医薬に続く分子標的医薬として注目されている。特に、脊髄性筋萎縮症を対象とした核酸医薬が4か国以上(日本を含む)で承認されて以降、脳や脊髄といった中枢神経の疾患を中心に臨床開発が急速に進んでいる。一方で、動物実験を用いた核酸医薬の開発の過程で髄腔内と呼ばれる中枢神経組織の周囲の空間に投与した際に、痙攣や意識障害、麻痺などの運動機能の異常といった副作用が出現することがあり、開発の障害となっている。
さらに、核酸医薬は一人一人の遺伝子の異常に応じて薬物の設計が可能であるため、患者数が非常に少ない遺伝性疾患に関しても個別の創薬開発が注目されている。しかし、そのような個別化治療のための創薬開発には候補薬の選別に時間的・金銭的にも大きな制約が存在する。以上から、中枢神経の疾患を標的とした際に副作用の無い核酸医薬の開発が望まれている。そこで、今回研究グループは核酸医薬の中枢神経における副作用の詳細な特徴や分子学的な原因の解明に着手した。
急性忍容性スコアを確立しマウスで解析、神経毒性は活動性低下が主体と判明
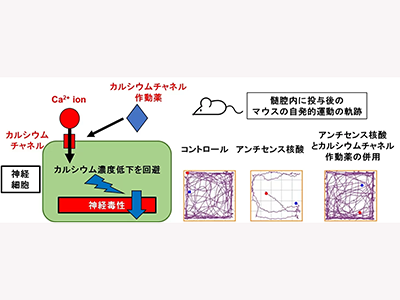
研究グループはまず、核酸医薬の1種であるアンチセンス核酸医薬をマウスの脳室内に投与した際に、その副作用の重症度を定量的かつ鋭敏に評価する方法の検討をした。その結果、意識の低下や過活動、運動機能異常といった5つのカテゴリーに分類した神経機能の異常をスコア化して評価する急性忍容性スコア(Acute Toxicity Scoring System:ATSS)を確立。ATSSを用いて、さまざまな伝子配列や化学修飾を有する核酸医薬を設計し、マウスに投与した際の神経毒性の行動学的特徴を解析した。その結果、意識の低下や自発的な運動機能の低下を来すような活動性の低下が主体であることが判明した。
3末端直近のグアニンの位置で神経毒性が変化、神経毒性をもつものは細胞内Caレベルを減少
次に、副作用におけるアンチセンス核酸の遺伝子配列や核酸化学修飾の影響を検討。遺伝子配列においては核酸分子の3末端から一番近いグアニン塩基の位置により神経毒性が変化することや、核酸糖鎖骨格や核酸間結合の修飾と神経機能異常の関係性を明らかにした。
最後に、アンチセンス核酸の神経機能異常の主な特徴が活動性の低下であることから、分子メカニズムとして細胞内カルシウム濃度の動態変化に着目。そこで、ラットの大脳皮質初代神経細胞を用いて細胞内遊離カルシウムレベルを評価したところ、神経毒性を有するアンチセンス核酸は細胞内カルシウムレベルを減少させていることを明らかにした。
Ca濃度調節チャネル・受容体の機能制御で、神経毒性改善の可能性
細胞内のカルシウム濃度を調節する各種のカルシウムチャネルおよびグルタミン酸受容体のアンチセンス核酸の神経毒瀬における影響を検討するために、それらチャネルや受容体のモジュレーターとアンチセンス核酸を併用して投与した際の、細胞内カルシウム濃度への影響やマウスでの神経毒性への影響を検討した。その結果、電位依存性カルシウムチャネルの活性化剤を併用すると、アンチセンス核酸による細胞内カルシウム濃度の低下を回復させ、マウスの神経毒性も改善することが明らかになった。また、AMPA型のグルタミン酸受容体の拮抗薬の併用は、細胞内のカルシウム濃度低下を増悪させるとともにマウスでの神経毒性は悪化させた。逆に、AMPA型のグルタミン酸受容体の作動薬の併用は、細胞内カルシウム濃度の低下およびマウスでの神経毒性を改善させた。一方で、NMDA型のグルタミン酸受容体の拮抗薬は神経毒性への影響は認めなかった。
以上から、アンチセンス核酸医薬の神経系の副作用の特性や細胞内のカルシウム濃度低下による神経毒性機序が解明され、カルシウム濃度を調節するチャネル・受容体の機能を制御することで神経毒性を改善し得ることが明らかになった。
多様な神経疾患の治療法開発の成功に期待
アンチセンス核酸医薬は中枢神経の病気を中心に創薬開発が精力的に行われており、パーキンソン病や筋萎縮性側索硬化症、ハンチントン舞踏病といった神経難病やアルツハイマー型認知症といった頻度の多い神経疾患に対して臨床試験が進んでいる。そのため、同研究成果は多くの神経疾患の核酸医薬の治療法開発へ広い応用が可能と考えられるという。同研究成果を基に神経毒性を回避する基盤技術が開発されることで、多様な神経疾患の治療法開発の成功に結びつくことが期待される、と研究グループは述べている。
▼関連リンク
・東京医科歯科大学 プレスリリース



