脳の視索前野、体温調節を司る重要な司令塔の神経細胞については不明点が多い
名古屋大学は12月26日、脳の中で体温調節の司令塔として機能する神経細胞群をラットで同定したと発表した。この研究は、同大大学院医学系研究科統合生理学分野の中村佳子講師、中村和弘教授、順天堂大学大学院医学研究科脳回路形態学の日置寛之教授らの研究グループによるもの。研究成果は、「Science Advances」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
人間を含めた多くの哺乳類の体温は約37°Cに厳密に維持され、この「温熱恒常性」は恒温動物の最大の特徴である。生体内の化学反応や機能分子は正常体温で機能するように最適化されているため、体温の厳密な維持がうまくいかなくなり、正常な温度域から逸脱すると、熱中症や低体温症で見られるように体内のあらゆる調節機能が損なわれ、最悪の場合、生命を維持できなくなる。したがって、体温を調節する基本的なメカニズムの解明は基礎生命科学にとどまらず、臨床医学的にも大きな意義を持つ。
体温調節を司る脳の中枢は、視床下部の最前部の視索前野に存在する。視索前野は深部体温(脳温)をモニターするだけでなく、環境の温度の情報を皮膚の温度センサーから感覚神経を介して受け取る。視索前野はこれらの温度情報を統合した上で、体温を調節するための司令を交感神経系などへ出力することにより、自律的な(意志に影響されない)体温調節反応を起こす。その反応には、褐色脂肪組織での熱産生、皮膚血管の収縮・弛緩(熱放散量の調節)、骨格筋のふるえ熱産生などがある。さらに視索前野は、感染時に産生される発熱メディエーターであるプロスタグランジンE2を受容することで発熱を司令する。
しかし、視索前野の中で体温調節を担う神経細胞群については世界中で探索が行われているが、いまだ不明な点が多くある。特に体温調節の司令塔として最も重要な、必要に応じて体温を上昇・低下させる司令を出力する体温調節の「マスター神経細胞」の存在は知られていなかった。
体温を上げ下げするときにEP3ニューロン群の活性化が関与
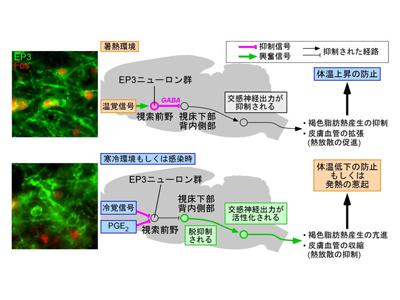
研究グループはこれまでに、プロスタグランジンE2を受容するタンパク質であるEP3受容体を特異的に可視化することができる世界で唯一の抗体の作製に成功しており、今回の研究では、EP3受容体を発現する視索前野の神経細胞群(EP3ニューロン群)に着目した。まず、EP3ニューロン群の神経活動が環境温度の変化に応じて変化するかどうかを調べるために、暑熱(36°C)、室温(24°C)あるいは寒冷(4°C)に2時間曝露したラットの視索前野における神経活動を、活性化神経マーカーであるFosタンパク質の発現を指標に解析した。すると、ラットにとって快適な環境温度域(約28°C)よりも低い室温あるいは寒冷に曝露したラットではEP3ニューロン群の神経活動は低く、一方、暑熱曝露したラットではEP3ニューロン群の活動が有意に上昇していた。このことから、体温を上げないようにする(下げようとする)必要があるときにはEP3ニューロン群が活性化することがわかった。さらに、プロスタグランジンE2を脳内に投与すると、発熱が起こるとともに、暑熱曝露によるEP3ニューロン群の活動上昇が抑制されたことから、体温を上げる必要があるときにはEP3ニューロン群の活動が低下することがわかった。
EP3ニューロン群、視索前野から交感神経系を活性化する視床下部背内側部へと神経伝達
次に研究グループは、視索前野のEP3ニューロン群の神経伝達先と使用する伝達物質を調べるため、視索前野のEP3ニューロン群に外来遺伝子を発現させることを可能にする遺伝子改変ラットを作製し、このニューロン群選択的に細胞膜移行型緑色蛍光タンパク質(palGFP)を発現させた。palGFPは細胞の膜構造を標識できるため、標識されたニューロンの軸索(神経線維)を末端まで明瞭に可視化する。観察の結果、EP3ニューロン群は視索前野からさまざまな脳領域へ神経伝達することがわかった。中でも、交感神経系を活性化することが知られる視床下部背内側部へ多数の軸索が伸びており、シナプス様の構造を形成していることが観察された。
神経終末は視床下部背内側部へGABAを放出、シナプスを介して神経伝達
そこで、免疫組織化学の手法を用いて、視床下部背内側部に分布する、視索前野EP3ニューロン群由来の8万個以上の神経終末を詳細に解析すると、その多くが抑制性神経伝達物質GABAの放出に関わる小胞型GABA輸送体(VGAT)タンパク質を含有することがわかった。一方、興奮性神経伝達物質グルタミン酸の放出に関わる小胞型グルタミン酸輸送体(VGLUT2)を持つ神経終末はわずかだった。さらに、電気生理学的解析を行うことで、視床下部背内側部に分布するEP3ニューロン群の神経終末からGABAが放出され、シナプスを介した神経伝達が行われることも確認した。これらの実験結果は、視索前野のEP3ニューロン群が視床下部背内側部へGABAを放出することで、交感神経系への出力を抑制することを示している。興味深いことに、2週間暑熱曝露したラットでは、視床下部背内側部でVGATを含有するEP3ニューロン群の神経終末の数が有意に増加していた。これは、長期の暑熱曝露中には熱産生などの不必要な交感神経反応を効率よく抑制する必要があり、そのためのシナプス変容が生じたものと考えられる。
視索前野のEP3ニューロン群、交感神経抑制信号の強さを精密に制御して体温を調節・維持
さらに研究グループは、視索前野のEP3ニューロン群の体温調節における機能を調べるために、化学遺伝学的手法を用いて視索前野のEP3ニューロン群の活動を人為的に操作する実験を行った。このニューロン群を活性化すると、皮膚血管が拡張して体熱の放散が促進されるとともに体温が低下した。一方、このニューロン群の活動を抑制すると、褐色脂肪組織の熱産生が活発化して体温が上昇した。同様に、視索前野から視床下部背内側部へのEP3ニューロン群の神経伝達を選択的に抑制しても褐色脂肪組織の熱産生が活発化した。
これらの実験結果をあわせて考えると、視索前野のEP3ニューロン群は視床下部背内側部へ恒常的にGABAを放出することによって交感神経を抑制する信号を送っており、その抑制信号の強さを精密に制御することにより体温を上下に調節し、設定レベル(セットポイント)に維持することを示している。例えば、暑熱環境ではその抑制信号を強めることによって交感神経系が抑制され、その結果、皮膚血管を拡張する熱放散反応が起こることで体温の上昇を防ぐ。一方、寒冷環境ではその抑制信号を弱めることによって交感神経系が活性化され、その結果、褐色脂肪組織での熱産生が活発化するなどして体温の低下を防ぐ。感染時にもプロスタグランジンE2がEP3ニューロン群に作用してその活動を抑制するため、交感神経系が活性化され、体温の上昇(発熱)が起こると考えられる。
体温を制御する脳の神経回路メカニズム、体温の人工操作や肥満治療技術にもつながる可能性
今回の研究は、臓器間ネットワークによる生体恒常性維持の分子・細胞メカニズムの解明に挑んだものであり、この研究においてEP3ニューロン群が体温調節の司令塔におけるマスター神経細胞として機能することが明らかになったことにより、今後、体温や代謝を制御する脳の神経回路メカニズムの全貌の解明が期待される。特に今回得られた知見は、「私達の体温はどのようにして37°Cという決まった温度に設定されているのか?」、「神経細胞の中に存在する何がその設定温度を決定するのか?」などといった生命科学における基本的な重要問題の解明につながる研究成果である。
また、人間の視索前野のEP3ニューロン群を人為的に操作する技術を開発することができれば、これまで困難であった体温の人工操作が可能となり、熱中症・低体温症の治療や全身麻酔下での手術における体温管理など、幅広い医学分野への応用が期待できる。特に、地球温暖化に伴う熱波が世界的に問題になっていることから、暑熱環境に適応し、生き抜くための技術開発は重要性を増している。
さらに、体温の調節には褐色脂肪組織の代謝熱産生など、エネルギーを消費する反応を伴うため、視索前野のEP3ニューロン群を人為的に操作して長期的に体温をわずかに上昇させることができれば、脂肪の燃焼を促進することができ、新たな肥満治療技術となる可能性がある。また、脂肪代謝異常がリスク因子となる糖尿病をはじめとする多くの疾患の発症前での診断と予防技術の開発にもつながる可能性がある。「今後、視索前野のEP3ニューロン群を軸としたさまざまな研究の展開が期待される」と、研究グループは述べている。
▼関連リンク
・名古屋大学 研究成果発信サイト



