キネシンスーパーファミリー「KIF4」と、不明点の多いてんかんのメカニズムの関連を解析
東京大学は12月9日、キネシン分子モーターKIF4の変異が、結合タンパク質PARP1の活性を抑制してしまうために、海馬の神経細胞における樹状突起分枝の異常な増加や、細胞内のCl–イオン動態の障害などを引き起こし、マウスがてんかんになりやすくなることを発見したと発表した。この研究は、同大大学院医学系研究科の廣川信隆特任研究員、Wan Yuansong特任研究員らの研究グループによるもの。研究成果は、「Journal of Cell Biology」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
てんかんは最も一般的な神経疾患の一つであり、日本では約100万人(有病率は1,000人に8人程度)、世界中では約5000万人が罹患すると言われている。てんかんの発症には、神経の形態異常、細胞内外のミネラル動態異常、外傷、薬の副作用など、様々な要因があることが知られているが、その発症メカニズムの詳細については不明な点が多く残っていた。
キネシンスーパーファミリータンパク質(KIFs)は細胞内の物質輸送を担う分子モーターであり、機能分子の局在や活性を制御することで細胞の生命や機能を維持する重要なタンパク質群である。これまでに多くのKIFsが脳の高次機能や個体の発生に大きな役割を持つことが示されてきたが、X染色体に存在し、神経系に多く発現する「KIF4」の役割に関してはまだあまり研究が行われていなかった。
小児てんかん患者から同定したKif4変異を持つモデルマウスを作製・解析
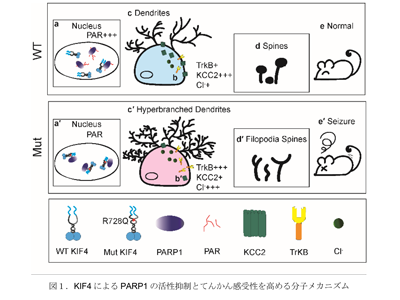
研究グループはこのKIF4に注目し、小児のてんかん患者からKIF4の728番目のアミノ酸であるアルギニンがグルタミンに変異しているミスセンス変異(p.R728Q)を同定した。そこで遺伝子操作により患者と同じKif4変異を持つマウスを作製し行動解析を行ったところ、幼若マウスで発達遅延が見られた。成体のKif4変異マウスは過活動の傾向と記憶・学習能力の低下を示した。またペンチレンテトラゾール化合物(PTZ)を腹腔内注射し脳波測定を行ったところ、Kif4変異マウスが低濃度でもてんかん発作を起こす様子が観察された。これらの結果から、Kif4変異マウスは患者と同様の表現型を持つモデルマウスとして研究を行うことが可能であると判断した。
KIF4・R728Q変異<PARP1と強く結合<PARP1の活性低下<TrkB下流のシグナル変化
研究グループの先行研究によりKIF4は核に局在して細胞死及び遺伝子発現に重要な役割を担うPARP1と結合し、神経細胞の活動依存性に生・死の制御を行う事を示しているが、BioID法及び免疫沈降法の実験結果から、KIF4とPARP1の結合がR728Q変異により異常に強くなることがわかった。さらにマウスの胎児から海馬の初代培養神経細胞を樹立し、PARP1の酵素産物であるPARの量を免疫細胞化学的に評価すると、変異型で有意な低下が見られたことから、PARP1の酵素活性がKIF4の変異により強く抑制されていることがわかった。その結果、Kif4変異神経細胞は生存率が低下していた。また、先行研究により、PARP1の活性変化は細胞のプロテオミクスプロファイルの変動を引き起こすことがわかっている。そこで研究グループは、Kif4変異マウスの脳組織及び初代培養神経細胞のタンパク質を抽出し、イムノブロット法を用いててんかんに関わるさまざまなタンパク質の発現量を調べたところ、Kif4変異が神経栄養因子受容体TrkBの増加及びTrkBの下流の一連のシグナル変化を引き起こすことを発見した。特にTrkBの下流因子の一つであるKCC2の低下が顕著であり、KIF4によるPARP1を介したこれらの機能タンパク質の発現量の調整が、てんかんの病理に関係することが示唆された。
TrkB-KCC2シグナル伝達が失われ、神経細胞の樹状突起で異常な分枝
次に、TrkBによるシグナル伝達が神経細胞の形態に重要な役割を担っていることから、海馬の初代培養細胞をセミ超高解像レーザー顕微鏡で観察したところ、変異型KIF4初代培養細胞では樹状突起の分枝の異常な増加及び幼弱なスパインの増加が見られた。また野生型の初代培養細胞に、変異Kif4遺伝子を導入したりPARP1の阻害剤DHIQを添加したりすると、変異型と同様の表現型を示した。そこでKIF4がPARP1-TrkBを介して神経細胞の形態を制御していることを確かめるため、DHIQ処理して分枝が異常に増加した野生型神経細胞にTrkBの阻害剤ANA12及びPARP1酵素の基質NAD+を添加すると、樹状突起数は野生型と同じレベルにまで減少しスパインも成熟化した。一方、変異型KIF4初代培養細胞へのPARP1の強制発現またはANA12あるいはNAD+の添加によっても、野生型と同じレベルへの回復が見られた。この条件で機能タンパク質の発現量を評価したところ、NAD+の添加により変異型KIF4初代培養細胞におけるTrkB及びKCC2の発現量は正常に回復した。したがってKIF4はPARP1活性を介してTrkB-KCC2シグナル伝達を制御することで神経細胞の形態形成を制御していると示唆された。このシグナル伝達の制御に分子モーターKIF4が関与していることは、世界で初めての報告である。
KCC2はCl–の輸送を介しててんかんの発症に関わっているため、Cl–センサー蛍光タンパク質を用いて初代培養細胞のイメージングを行ったところ、変異型KIF4神経細胞は細胞内の塩化物濃度が高かったが、NAD+の添加により低下した。そこで、NAD+の抗てんかん薬としての可能性を検討するため、Kif4変異マウスにNAD+を腹腔内注射しPTZを用いててんかんを誘発したところ、野生型マウスと同程度にてんかんを発症しにくくなった。
発症メカニズムが未解明のてんかん、根本的な治療法開発の基盤として期待
変異型KIF4の分子細胞生物学的・神経細胞学的な特徴は、てんかんマウスの表現型としてこれまでに報告されたものとよく一致しており、このマウスの解析を通じてTrkB及びKCC2の機能異常がてんかん発症に関与していることが提唱された。てんかんは1,000人に8人が発症すると言われているが、発症メカニズムの全容が解明されていないため、根本的な治療法はまだ十分開発されていない。「今回、KIF4がPARP1の活性を介してTrkB-KCC2シグナル伝達を調整し神経細胞の形態形成や細胞内のCl–ダイナミクスを維持すること、そしてKIF4の変異によってその機能が障害されるとてんかんの発症につながるという新規の分子メカニズムが明らかになった。この研究成果は、てんかん治療法開発の基盤の一つになると期待される」と、研究グループは述べている。



