心臓オルガノイドを用いて実際の臓器に近い細胞環境を再現し、薬剤の効果を評価
京都大学iPS細胞研究所(CiRA)は11月21日、心臓オルガノイドを用いた薬剤心毒性評価のための前臨床モデルについて報告したと発表した。この研究は、CiRA増殖分化機構研究部門 医学研究科のYu Tian大学院生、同部門のAntonio Lucena-Cacace特命助教、吉田善紀准教授らの研究グループによるもの。研究成果は、「Frontiers in Cell and Developmental Biology」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
心臓の線維芽細胞は、心臓が傷害を受けた際に線維化を生じさせ、創傷治癒を担う重要な存在だ。一方で、線維化は心臓の機能の十分な回復を妨げることにもつながる。傷害を受けた心臓の機能を適切に回復させるためには、線維化を改善する治療が必要となる。
これまで、線維化を改善させるための新しい治療法を発見するために、線維芽細胞のみを考慮した実験が行われてきた。しかし、細胞間のクロストークが薬剤の効果に重要な影響を与える可能性があることが知られている。そこで研究グループは今回、iPS細胞由来の複数種の細胞からなる心臓オルガノイドを用いて実際の臓器に近い細胞環境を再現することにより、薬剤の効果を評価した。
p38阻害剤単独またはタクロリムス・シロリムスとの併用で線維化を抑制
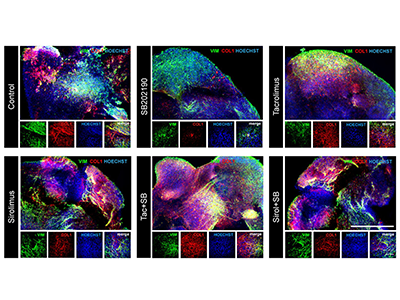
研究グループはまず、TGFβ1による線維化反応を抑える薬剤として、mTOR阻害剤である「シロリムス(Sirolimus)」、カルシニューリン阻害薬である「タクロリムス(Tacrolimus)」という2種類の免疫抑制薬、p38阻害薬である「SB202190」の3つの薬剤に着目し、培養したヒト心臓線維芽細胞においてTGFβ1刺激による線維化の指標として、「COL1A1」発現の評価を行った。
その結果、SB202190とシロリムスが、それぞれ単剤でTGFβ1刺激によるCOL1A1の発現を抑制した。さらに、SB202190とタクロリムスまたはシロリムスの併用によって、COL1A1の抑制効果が確認された。
心臓線維芽細胞単独モデルと心臓オルガノイドとでは異なる結果
次に、ヒトiPS細胞から3ステップによる分化誘導プロトコールにより、心筋細胞(TNNT2陽性)、心外膜細胞(WT1陽性)、心内膜細胞(NFATC1陽性)、心臓線維芽細胞(VIM, THY1陽性)を含むオルガノイドを作製した。
さらに、作製した心臓オルガノイドにおいて、前述のp38阻害薬SB202190と2種類の免疫抑制剤(シロリムスとタクロリムス)の効果を評価した。その結果、TGFβ1によるCOL1A1の発現は、SB202190によってのみ抑えられた。一方、SB202190とタクロリムスまたはシロリムスの併用においては、COL1A1の発現は抑えられず、SB202190による抗線維化効果は、これらの薬剤により失われてしまうことが確認された。
これらのことから、心臓線維芽細胞単独のモデルにおいては、p38阻害薬単独あるいはp38阻害薬と免疫抑制剤(タクロリムス、シロリムス)の併用は線維化を抑制する効果が認められた。一方、複数の細胞種からなる心臓オルガノイドにおいては、p38阻害薬による心臓線維化抑制作用は、タクロリムス、シロリムスの併用により打ち消されることが明らかになった。
心臓線維芽細胞単独のモデルと心臓オルガノイドにおいて異なる結果が得られたのは、線維芽細胞以外の細胞を介した反応が、p38阻害薬による抗線維化効果を変化させることによるものと考えられた。
3次元オルガノイドを用いた心疾患モデルの創薬研究や個別化医療への応用に期待
今回の研究では、心臓を含む多くの臓器に影響を与える線維化に対して治療効果を示すp38阻害薬と免疫抑制剤の併用による影響が検討された。その結果、複数の種類の細胞からなるiPS細胞由来心臓オルガノイドを用いることにより、p38阻害薬は線維化の抑制において抗線維化作用を示したが、心臓オルガノイドでp38阻害薬と免疫抑制剤を併用すると抗線維化作用は打ち消された。この結果は、心臓組織(オルガノイド)において、線維芽細胞以外の細胞が薬剤に対する反応を調節していることを反映していると考えられる。
「この3次元オルガノイドを用いた心疾患モデルは、患者由来iPS細胞を用いた創薬研究や個別化医療への応用が期待できる」と、研究グループは述べている。
▼関連リンク
・京都大学iPS細胞研究所(CiRA) ニュース




