増加する心臓血管手術の件数、術後の多臓器合併症への対処が課題
理化学研究所(理研)は11月14日、心臓血管手術に伴う腎臓障害モデルマウスに冬眠様状態を誘導する実験により、疾患状態の動物を人工的に冬眠させることで臓器の障害が軽減される可能性を示したと発表した。この研究は、理研生命機能科学研究センター 個体パターニング研究チームの升本英利上級研究員(臨床橋渡しプログラム・升本研究室研究リーダー、京都大学医学部附属病院心臓血管外科特定助教)、老化分子生物学研究チームの砂川 玄志郎上級研究員(研究当時、現 冬眠生物学研究チーム チームリーダー)、京都大学大学院医学研究科心臓血管外科の許敞一博士課程学生らの研究グループによるもの。研究成果は、「JTCVS Open」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
動脈硬化に起因する循環器疾患は増加の一途をたどっており、世界的に見ても主要な死因の一つとなっている。循環器疾患の外科治療である心臓血管手術の件数も近年増加傾向にあるが、大動脈手術など循環停止を必要とする手術においては、術中臓器虚血による術後臓器の機能不全が問題となっている。今後、循環器以外に合併症を持つ高齢患者が増加する可能性を考慮すると、心臓血管手術後の多臓器合併症へのさらなる対処が課題となる。特に、急性腎障害(AKI)は術後の主要な合併症であり、短期および長期の死亡率の上昇と関連している。循環停止を伴う大動脈手術後のAKI発症率は5〜50%と高く、循環停止とそれに伴う腎臓の虚血がAKIの原因であることを示している。
低体温は虚血による臓器障害を回避するも、凝固障害や感染性合併症のリスクを高める
虚血により臓器が低酸素状態に陥ると、組織に回復不可能な障害をもたらす場合がある。一方、体温を強制的に低下させると組織が低代謝状態となり、酸素消費量は減少する。酸素消費量が減少した臓器は低酸素状態に耐性を持つと考えられ、1950年代から心肺停止や脳死などの蘇生医療において体温を下げることの利点が数多く報告されている。循環停止を必要とする心臓血管外科の分野では、1970年代から20℃以下の超低体温による低代謝の誘導が、循環停止中の臓器保護に広く応用されている。しかし、低体温を介した術後の凝固障害や血小板機能障害により、術後の出血の危険性や輸血の必要性が高まるとされている。さらに、超低体温法は手術時間の延長の原因となり、術後の感染性合併症のリスクを高める可能性がある。
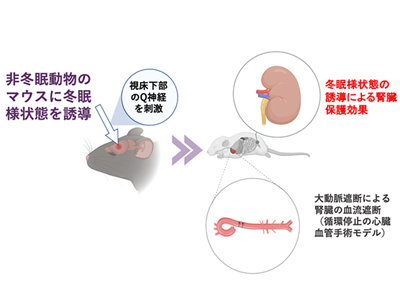
リスなどの一部の哺乳類は、冬眠または休眠と呼ばれる、低体温と低代謝に伴う生理的活動の低下状態になることがよく知られている。冬眠動物は、食物摂取量やエネルギー生産量が極端に減少し、体温や代謝が低い状態で生存できる。マウスは通常の状態では冬眠しない非冬眠動物として認識されているが、研究グループは、脳の視床下部にある特定の神経細胞(Q神経)を刺激すると、マウスを冬眠様状態にできること(Q神経誘導性低代謝:QIH)を2020年に明らかにしていた。この発見は、非冬眠動物であるヒトも冬眠様状態に入ることができる可能性を示している。
超低体温法に代わる冬眠様状態QIHによる腎臓保護効果を検討
循環停止を必要とする心臓血管手術において、超低体温法に代わる冬眠様状態(代謝低下状態)の誘導は、将来的に腎臓保護のための全く新しい戦略になると期待される。そこで今回の研究では、Q神経の活性化により代謝低下を誘導する遺伝子改変マウス(QIHマウス)を用いて、QIHによる循環停止時の腎臓保護効果を検討した。
研究グループは、循環停止を伴う大動脈手術を模した非臨床研究として、QIHマウスおよび対照マウス(QIHを誘導しないこと以外は同じ条件のマウス)の胸部下行大動脈を遮断してマウス下半身に虚血を誘導する処置を行った。また体温と腎臓障害の関係を調べるため、ヒーターおよびクーラーの使用により体周囲の温度を制御することで正常体温群(35.0±1.3℃)と低体温群(21.5±1.3℃)に分け、虚血誘導後に血液および腎臓を採取して腎臓障害の程度を評価した。
腎臓障害のAKI診断マーカーNGALとシスタチンC、QIHマウスで有意に低い値
まず、組織学的解析により腎尿細管障害の程度を調べたところ、対照マウスの正常体温群では重度の腎尿細管損傷が観察された。腎尿細管損傷の半定量的評価では、QIHマウスと対照マウスはともに、正常体温群では低体温群に比べて腎尿細管損傷スコアがそれぞれ有意に上昇した。一方、QIHマウスと対照マウスの正常体温群同士を比較すると、両群で統計的有意差はなかった。これらの結果は、QIHの有無にかかわらず、低体温が腎臓を亜致死的な腎尿細管障害から保護することを示している。一方で、正常体温におけるQIHの腎臓保護効果をさらに検討するためには、腎臓の病理組織学的な変化が出現するより早期に腎臓障害を検出しうるマーカーによる検討が必要と考えられた。
そこで、採取した血液を用いてAKI診断マーカーによる評価を行った。タンパク質NGALは尿または血漿で測定され、構造的腎臓障害の高感度バイオマーカーとして知られている。QIHマウスと対照マウスの正常体温群を比較すると、QIHマウスは対照マウスに対して有意に低いNGAL値を示した。一方、QIHマウスの正常体温群と低体温群の間には有意差はなかった。また、血清タンパク質であるシスタチンCは、早期腎機能障害の非常に特異的なバイオマーカーとして知られている。シスタチンCもNGALと同様に、正常体温群においてQIHマウスでは対照マウスよりも有意に低い値を示し、QIHマウス同士では正常体温群と低体温群の間には有意差はなかった。これらの結果からQIHは、正常体温下の虚血による機能不全から、腎臓を部分的に保護することが示された。
今後ヒトにQIHを誘導する手法も開発予定
今回の研究では、マウス虚血モデルにおいて、低体温が腎臓の構造的な障害からの保護に有効であることを示すとともに、QIHにより正常体温下でもAKIが一部改善されることを見いだした。「今後、ヒトにQIHを誘導する手法が開発できれば、将来的には循環停止を伴う心血管手術において、低体温で循環停止させることなく、十分な腎臓保護を実現するための有望なアプローチとなる可能性がある」と、研究グループは述べている。
▼関連リンク
・理化学研究所 プレスリリース



