SLEの病態に関わるとされるpDC、そのマイクロRNA変化や病態への関与は?
名古屋大学は11月11日、全身性エリテマトーデス(SLE)の病態において2つのマイクロRNAの異常が重要であることを見出し、さらに、統合的バイオインフォマティクスを通じて、2つのマイクロRNAの働く仕組みの多様性と、進化的変遷の特徴を明らかにしたと発表した。この研究は、同大大学院医学系研究科腎臓内科学の北井啓己大学院生・客員研究員(現 米国デューク大学博士研究員)、加藤規利講師、丸山彰一教授、分子生物学の門松健治教授、分子腫瘍学の鈴木洋教授らの研究グループによるもの。研究成果は、「BMC Biology」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
マイクロRNAは、長さ約22塩基の小さなRNAで、さまざまな標的mRNAに結合することで標的mRNAを抑制する重要な遺伝子調節のプレーヤーである。その調節異常は多くの疾患に関与していることが報告されてきた。従来、1つのマイクロRNAが標的遺伝子を抑制する効果は小さく、2つ以上のマイクロRNAが同じ標的遺伝子の「違う配列」に結合することで協調的に遺伝子を抑制することが注目されてきた。一方で、多様な疾患で複数のマイクロRNAの発現異常が報告されているが、複数のマイクロRNAの発現異常の組み合わせがどのように疾患の病態に関与しているかについては詳細な検討はされていなかった。
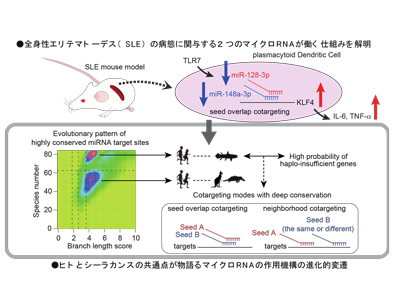
全身性エリテマトーデス(SLE)は、自己抗体の産生が起きることで、全身臓器に免疫複合体が沈着する疾患であり、免疫抑制薬による治療にも関わらず10~30%の患者が末期腎不全に至る難治性の自己免疫疾患である。SLEの病態には形質細胞様樹状細胞(プラズマサイトイド樹状細胞、pDC)が大きく関わっており、pDCに関わる病態をターゲットとした新規治療薬の開発が試みられているが、その開発は難渋しており、より詳細にSLEにおけるpDCの役割を検討する必要性がある。SLEでは、さまざまな免疫細胞においてマイクロRNAの発現異常が報告されているが、pDCにおけるマイクロRNAの変化についてはこれまで深く検討されていなかった。研究グループは、SLEマウスモデルのpDCにおけるマイクロRNAの発現異常に注目し、さらに統合的バイオインフォマティクスを通じて、2つのマイクロRNAの働く仕組みの多様性と、進化的変遷の特徴を解析した。
モデルマウスのpDC、2つのマイクロRNAが発現低下<KLF4が発現上昇<炎症応答促進
研究グループは、Toll様受容体TLR7のアゴニスト(作用薬)であるイミキモド(IMQ)をマウスの耳に塗ることでpDCが刺激され全身においてSLE症状が出現するSLEマウスモデルから、pDCを分離し、網羅的にマイクロRNAの発現変動を解析した。この結果、コントロールマウスと比較してSLEモデルマウスのpDCにおいて、2つのマイクロRNA(マイクロRNA-128・マイクロRNA-148a)が低下していることを見出した。ヒト形質細胞様樹状細胞株でこの2つのマイクロRNAが炎症応答を調節している可能性を検討したところ、TNFα、IL-6といった炎症性サイトカインの産生が、2つのマイクロRNAを導入した場合に、1つのマイクロDNAだけを導入した場合よりも強く抑制されることが明らかになった。この現象のメカニズムを明らかにするため、この2つのマイクロRNAの標的遺伝子を探索した結果、2つのマイクロRNAがKLF4と呼ばれる標的遺伝子の「重複した配列」に付加的に作用することでより強くKLF4を抑制することを見出した。より詳細な検討の結果、2つのマイクロRNAの低下と、これに呼応するKLF4の上昇が炎症応答を促進しSLEの病態に関与する可能性が示唆された。
重複した標的配列は、複数のマイクロRNAから遺伝子発現を抑制される可能性が高まる
2つのマイクロRNAは厳密には配列が違うため、必ず同じ遺伝子に結合し抑制するわけではない。では、2つのマイクロRNAはどのようにして、どのような条件で同じ遺伝子を制御するのか。そして、2つのマイクロRNAによって調節されることにはどのような意義があるのだろうか。マイクロRNA-128・マイクロRNA-148aは、違う配列ではあるが、標的遺伝子と結合する配列が類似しているため、それぞれの標的遺伝子の約15~20%程度が2つのマイクロRNAによって結合される可能性がある。このような標的遺伝子は炎症の制御に深く関係していることがわかり、さらに、2つのマイクロRNAがこのような「重複した標的配列」を持つ遺伝子にどのような影響を及ぼすかを網羅的遺伝子発現解析で検討したところ、「重複した配列」を持つ場合に遺伝子抑制の可能性が高まることがわかった。
マイクロRNA-128・マイクロRNA-148aとKLF4の配列の関係性、ヒトとシーラカンスで共通
興味深いことに、マイクロRNA-128・マイクロRNA-148aとKLF4の配列の関係性はヒトとシーラカンスで共通していた。この知見をもとに、研究グループは、2つのマイクロRNAが同じ標的遺伝子を制御するということと、マイクロRNAと標的遺伝子の配列の関係性が進化の過程で保存されるということに何らかのつながりがあるのではないかという仮説をたて、統合的バイオインフォマティクスを通じて、ヒトからシーラカンスまで84種類の生物種についてマイクロRNAと標的遺伝子の関係性を詳細に検証した。この結果、以下のさまざまな知見が見出された。
(i)「重複した配列」を通じて同じ標的遺伝子を制御しうる全てのマイクロRNAのペアのカタログを作成。
(ii)これらのマイクロRNAのペアは、炎症応答や細胞周期など特徴的な細胞の機能を制御している可能性がある。
(iii)進化的によく保存されたマイクロRNAは、他のマイクロRNAと類似した配列を持つ可能性が高く、ゆえに、同じ標的遺伝子を制御する可能性が高くなる。
(iv)類似した配列のマイクロRNAは、ゲノム上に複数コードされたり、複数のマイクロRNAを含んだ1つのRNAから作られたりする可能性が高い。つまり、これらのマイクロRNAの発現量の厳密な調整が生物学的に重要である可能性がある。
(v)マイクロRNAが制御する標的mRNAの標的サイト(標的配列)は、ヒトからシーラカンスまで幅広く保存されたものと、ヒトから有袋類までの哺乳類に保存されたものの大きな2つのグループがある。
(vi)ヒトからシーラカンスまで幅広く保存された標的サイト(標的配列)ほど、「違う配列」と「重複した配列」両方の様式を通じて、複数(2つ以上)のマイクロRNAによる制御を受けやすい。
(vii)ヒトからシーラカンスまで幅広く保存された標的サイト(標的配列)を持つ遺伝子ほど、遺伝子の発現量の変化が細胞の機能の変化につながりやすい。つまり、これらの標的遺伝子の発現量の厳密な調整が生物学的に重要である。
これらの知見をまとめると、マイクロRNAが制御する標的mRNAの標的サイト(標的配列)には、ヒトからシーラカンスまで幅広く保存されたものと、ヒトから有袋類までの哺乳類に保存されたものの大きな2つのグループがあり、より保存されたものほど「違う配列」と「重複した配列」両方の様式を通じて、複数(2つ以上)のマイクロRNAによる制御を受けやすいことが明らかになった。このような遺伝子は、複数のマイクロRNAの発現と標的遺伝子の発現のバランスによる制御が非常に重要であり、そのためにマイクロRNAと標的遺伝子の関係性がより強く進化の過程で保存されている可能性が考えられるという。
複数のマイクロRNAによる遺伝子制御の理解、SLE以外の疾患の病態の詳細な解明にも
今回研究グループは、SLEの病態に関係する2つのマイクロRNAの役割と、2つのマイクロRNAの働く仕組みの多様性・進化的変遷の特徴を明らかにした。こうした複数のマイクロRNAによる遺伝子制御の理解は、SLEのみならず、他疾患の病態の詳細な解明につながることが期待される。「マイクロRNAの研究分野では、マイクロRNAの標的配列を、進化系統樹を用いて、進化的により保存されたものと、そうでないものの大きく2つに分けるアプローチが広く使用されてきた。本研究では、非常に興味深いことに、進化的により保存された標的配列が、実は、ヒトからシーラカンスまで幅広く保存されたものと、ヒトから有袋類までの哺乳類に保存されたものの大きな2つのグループから構成されていることが浮き彫りになってきた。今回の発見を、従来の進化系統樹を用いたアプローチと組み合わせることで、マイクロRNAの機能をより正確に理解し、マイクロRNAを応用した核酸医薬のより精密な制御ができるようになることが期待される」と、研究グループは述べている。
▼関連リンク
・名古屋大学 研究成果発信サイト



