関節リウマチのゲノム医療を日本で実現のため、大規模東アジア人集団を含めたGWASが必須
理化学研究所(理研)は11月10日、関節リウマチの発症に関わる34個の遺伝的変異を新たに同定したと発表した。この研究は、理研生命医科学研究センターヒト免疫遺伝研究チームの石垣和慶チームリーダー、大阪大学大学院医学系研究科の坂上沙央里助教(ハーバード大学医学部博士研究員)、理研生命医科学研究センターゲノム解析応用研究チームの寺尾知可史チームリーダー、東京大学大学院新領域創成科学研究科の松田浩一教授、京都大学大学院医学研究科の松田文彦教授、産業医科大学医学部の田中良哉教授、大阪大学大学院医学系研究科の熊ノ郷淳教授、東京医科歯科大学難治疾患研究所の高地雄太教授、東京女子医科大学医学部の猪狩勝則特任教授、理研生命医科学研究センター自己免疫疾患研究チームの山本一彦チームリーダーらが参加し、理研生命医科学研究センターシステム遺伝学チームの岡田随象チームリーダー(大阪大学大学院医学系研究科教授)、ハーバード大学のショウモウ・レイチャウドリ教授らが統括する国際共同研究グループによるもの。研究成果は、「Nature Genetics」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
関節リウマチは、免疫システムが関節組織を破壊して機能が損なわれる原因不明の疾患である。関節リウマチの発症には、多くの遺伝的変異(リスク変異)が関与することが知られている。そのため、ゲノムワイド関連解析(GWAS)によってリスク変異を同定する研究が欧米を中心に行われてきた。しかし、大半のリスク変異の影響は非常に小さいため、従来のGWAS研究では一部のリスク変異しか同定できなかった。また、単一の人種集団を対象とするGWASでは、ゲノム上の近傍に位置する遺伝的変異間の相関関係のため、リスク変異をピンポイントで同定することは一般的に困難であり、その局在も不明瞭だった。一方、多くの患者・健常者のサンプルを多人種集団のコホート(集団)から集め、大規模にGWASを実施することで、変異間の相関関係の影響が緩和され、より多くのリスク変異を高い精度で同定できることが知られている。
近年、欧米人集団を対象に大規模なGWASが多数実施され、その解析結果は、疾患発症の予測などの目的で、臨床現場で実用性が示されつつある。一方、遺伝的変異の分布には人種差があるため、欧米人集団での解析結果を日本人集団に応用できる範囲は限定的である。そのため、日本において関節リウマチのゲノム医療を実現するためには、多くの東アジア人集団をGWASの対象に含めることが必須だと考えられている。
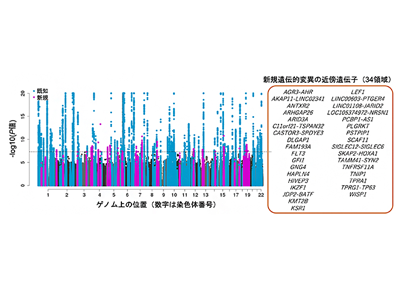
東アジア人が3分の1の大規模GWASを実施、計124のリスク変異を同定、34が新規
このような背景から研究グループは、日本人集団を含む東アジア人集団など五つの人種集団を対象とした関節リウマチのGWASを過去最大規模で実施した。今回の研究には、欧米人集団、東アジア人集団、アフリカ人集団、南アジア人集団、アラビア人集団から構成される37コホートが参加し、3万5,871人の関節リウマチ患者と24万149人の健常者、合計27万6,020人を対象にGWASを実施した。これは関節リウマチを対象としたものでは過去最大規模のものである。多くのGWASが欧米人集団中心に行われているのに対して、今回は患者の約3分の1(1万1,025人)が東アジア人集団であり、その大半は日本で収集されたサンプルだった。このGWASによって、合計124個のリスク変異が同定され、そのうち34個が新規の発見だった。
LEF1遺伝子座におけるリスク変異、最も高い精度でマッピング
さらに国際共同研究グループは、検出されたリスク変異の局在を近似ベイズ因子を用いて詳細にマッピングした。すると予想通り、単一人種集団でのGWASと比較して、多人種集団でのGWASでは、より精度の高いマッピング結果が得られた。今回の研究全体で、事後確率が50%を超える35個のリスク変異を同定することに成功した。最も高い精度でマッピングされたリスク変異はLEF1遺伝子座に同定された。LEF1遺伝子変異はCD4陽性T細胞の遺伝子発現制御領域にあることから、CD4陽性T細胞の遺伝子発現制御異常が発症リスクに関わることが示唆された。リスク変異の局在を高精度にマッピングすることは、変異の機能解析実験において重要な情報となることから、研究成果は関節リウマチの病態解明の加速につながると考えられる。
PADI4遺伝子座のリスク変異、スプライシングアイソフォームの評価により興味深い知見
リスク変異が引き起こす分子機序の解明を目指したところ、PADI4遺伝子座のリスク変異において興味深い知見が得られた。関節リウマチの最も特徴的な免疫異常が、シトルリン化されたタンパク質に対する自己抗体の存在である。PADI4遺伝子はシトルリン化を担う酵素をコードしている非常に重要な遺伝子である。英国のプロジェクトBLUEPRINTのデータベースとの統合解析によって、PADI4遺伝子変異は好中球でPADI4遺伝子のスプライシングに関与する可能性が示された。しかし、PADI4スプライシングアイソフォームの全体像は不明であり、詳細な分子機序を解明することができなかった。そこで、ロングリードシーケンスの技術を用いて、PADI4遺伝子の転写産物の全長配列を確認し、酵素活性に重要な部分を欠く新しい非機能性スプライスアイソフォームを特定した。
次に、105人の日本人集団の健常者からのRNAシーケンスデータを使用して、PADI4アイソフォームをそれぞれ定量評価した。すると、リスク対立遺伝子は、非機能性アイソフォームの発現量の減少、機能性アイソフォームの発現量の増加、全アイソフォームの合計発現量の減少と関連していることがわかった。つまり、アイソフォームごとの詳細な定量評価により、リスク対立遺伝子はPADI4遺伝子の機能を亢進させることが示唆された。この結果は、PADI4遺伝子の新しい遺伝的メカニズムを解明し、ロングリードシークエンスを使用して、リスク遺伝子座でスプライスアイソフォームを徹底的に調査することの重要性を示している。
東アジア人集団のPRS、欧米人集団と同程度の予測精度を観察可能に
最後に、今回の研究成果によって各人種集団の発症リスクがどの程度予測可能かを検証するため、ポリジェニック・リスク・スコア(PRS)を計算した。PRSはGWASの結果と個人の遺伝子変異情報を基に発症リスクを推定する指標であり、他の疾患では臨床現場での実用性が示されつつある。過去、多くの研究において東アジア人集団のPRS予測精度は欧米人集団よりも低くなることが多かったが、今回、東アジア人集団と欧米人集団とで同程度のPRS予測精度が観察された。これは、バイオバンク・プロジェクトなど日本人集団を中心とした東アジア人集団のサンプルを多く収集することに成功したためだと考えられる。
なお、このPRS計算では、発症リスクに強い影響を与えるHLA遺伝子変異の情報は用いていない。今後、HLA遺伝子変異の情報を加えることで、予測精度はさらに高まると考えられる。
研究グループは、「本研究結果は関節リウマチの発症に関わる生物学的機序を解明し、ゲノム創薬に貢献すると考えられる。研究結果は公共データベースで全て公開されるため、今後世界的に活用され多方面の研究活動を促進することが期待でき、PRSの発症予測精度が東アジア人集団と欧米人集団とで同程度であった結果から、日本におけるゲノム医療の実現に向けた議論を加速させることも期待できる」と述べている。
▼関連リンク
・理化学研究所 プレスリリース




