糖尿病患者の認知症発症を予測できる「血液バイオマーカー」を探索
京都医療センターは11月1日、糖尿病の認知症発症を早期に反映する指標は、血液中のsTREM2というタンパク質の減少である可能性を、世界で初めて明らかにしたと発表した。この研究は、同センター臨床研究センター内分泌代謝高血圧研究部の浅原哲子部長、同・山陰一主任研究員、量子科学技術研究開発機構の徳田隆彦医長、京都認知症総合センターの秋口一郎所長、健康科学大学の田中将志教授を中心とする研究チームらの共同研究によるもの。研究成果は、「Diabetes Research and Clinical Practice」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
超高齢化社会が進む日本では、認知症患者の増加が社会問題となっている。2025年には高齢者の5人に1人が認知症になると推計され、認知症による社会的コストは年間10兆円を超えると推定されている。認知症の中で最も多い原因疾患はアルツハイマー病で、全体の60〜70%を占める。また、高齢になるほど有病率が著明に増加する。
人口の高齢化により、高齢者糖尿病も著しく増加しており、厚生労働省の「国民健康・栄養調査」によると、糖尿病が強く疑われる成人患者の数は2016年時点で推計1000万人を超え、年齢が高いほど糖尿病有病者の割合が高くなる。さらに近年の疫学研究により、糖尿病は脳血管性認知症のリスクであるだけでなく、アルツハイマー病の発症リスクを2倍以上上昇させると報告されている。
以上のことから、糖尿病の適切な管理は認知症患者の増加抑制に極めて重要であると考えられる。また、認知機能低下は糖尿病治療の遵守や患者の健康寿命に悪影響を及ぼすため、糖尿病患者における認知症対策は喫緊の課題であり、認知症未発症段階における糖尿病患者の適切な管理と予防のためには、どのような糖尿病患者が認知症を発症するかを予測する非侵襲的で簡便な血液バイオマーカーの開発が急務となっている。
そこで研究グループは今回、糖尿病患者において認知症の発症を予測できる実臨床に応用可能な血液バイオマーカーを探索するとともに、糖尿病性認知症の脳病態の進展過程を、バイオマーカーの観点から明らかにしたいと考え、研究を行った。
糖尿病性認知症は老人斑が少ないなどアルツハイマー病と異なる脳病理、発症機序は?
アルツハイマー病は、脳の中で作られた可溶性の毒性Aβタンパクが、タウタンパクのリン酸化と細胞内への蓄積を引き起こし、そのリン酸化タウタンパクが大脳皮質に広がることによって大脳の神経細胞が広汎に障害され、認知症を発症すると考えられている。そのため、可溶性の毒性Aβが脳全体に拡散しないように、通常の病初期にはミクログリアが働き、Aβを不溶化して老人斑に閉じ込め、ミクログリアが老人斑周囲を取り囲みAβの拡散を防ぐバリアとなって、周囲の脳組織を保護していると考えられている。加齢などによって、このアルツハイマー病の病初期に働くミクログリアの保護的な活動が低下すると、Aβの拡散からリン酸化タウの誘導、細胞障害というアルツハイマー病理の進展カスケードが作動してしまう。
この考えを支持する知見として、ミクログリアに発現しているtriggering receptor expressed on myeloid cell 2(TREM2)の遺伝子変異(TREM2の機能低下)がアルツハイマー病の発症リスクを上げることが報告されている。TREM2は、その一部が可溶型TREM2(sTREM2)として放出され、そのsTREM2の量はミクログリアの活性化状態を反映しており、sTREM2はヒトの脳脊髄液および血液中でも定量することができる。さらに、家族性アルツハイマー病患者を登録して縦断的な研究を行っている米国のDIAN研究から、脳脊髄液中のsTREM2濃度が高かった家族性アルツハイマー病の保因者では、その後の脳萎縮・認知機能低下が遅かったことが示されている。
このように、糖尿病は認知症のリスク因子であることが判明している。糖尿病患者に出現する「糖尿病性認知症」においては、アルツハイマー病とは異なる脳病理の特徴が、PET検査を用いた研究で報告されている。そこでは、アルツハイマー病の最初期病変である老人斑(Aβ蓄積から構成)の形成がわずかであり、一方、Aβの下流にあるリン酸化タウタンパク質は蓄積し、認知機能が低下することが認められていた。しかし、糖尿病性認知症に関しては、その発症・進展機序の詳細は解明されておらず、低侵襲で安価な診断法や認知症発症予測バイオマーカーも開発されていない。
糖尿病/非糖尿病患者で血中sTREM2濃度、Aβ42/40比、pTau、NfL濃度を測定し解析
一方、アルツハイマー病の研究領域では、その脳病変の進展状況に対応する脳脊髄液バイオマーカー(ATNバイオマーカー)が確立されており、多項目のバイオマーカーが脳病態の進展に応じて変化していく時系列が明らかになっている。また、近年の顕著な技術的進歩により、従来は脳脊髄液中でしか測定できなかったアルツハイマー病関連バイオマーカーが、血液中でも測定できるようになってきている。
特に、脳内の不溶性Aβアミロイドの沈着量を反映する血中のAβ42/40比、血中リン酸化タウタンパク質、および血中ニューロフィラメント軽鎖が、世界標準のアルツハイマー病の血液バイオマーカー(ATNバイオマーカー)となっている。このように、アルツハイマー病では脳内に不溶化したAβ42を主体とする老人斑が形成されるため、血液中の可溶性Aβ42/40比は低下し、一方で脳にリン酸化タウタンパクが増えて神経細胞が障害されるため、血液中のpTauとNfLは増加することが判明している。
同研究代表者である浅原哲子部長はこれまでに、sTREM2が糖尿病患者の認知機能低下と関連していること、および世界でも最高水準の地域住民を対象にした疫学研究である久山町研究の住民コホートで、血中sTREM2が認知症の新規バイオマーカーとなることを報告している。また、同研究に参加している量研の徳田隆彦医長は、アルツハイマー病の病因タンパクであるp-tauをヒト血液中で検出できる測定系を世界で初めて開発し、アルツハイマー病診断における有用性を報告している。また、徳田医長は国際的に標準となっているアルツハイマー病のATNバイオマーカーを全て血液中で測定できる技術を有し、同研究でもそれらの多項目血液バイオマーカーを包括的に検討した。
今回の研究では、京都認知症総合センタークリニックで経過観察と加療を受けている糖尿病患者(47人)と非糖尿病患者(74人)を対象に、糖尿病の病歴と経過、認知機能検査、画像診断などの臨床情報を収集し、保存されていた血液検体を用いて、ミクログリアの機能を反映する血中sTREM2およびアルツハイマー病の多項目血液バイオマーカー(ATNバイオマーカー: Aβ42/40比、pTau、NfLなど)を測定し、患者の認知機能障害の程度によって分類した正常群・軽度認知障害群・認知症群の間で、これらの血液バイオマーカーの変動を解析。sTREM2の測定はa RayBiotech Human TREM-2 ELISA法で行った。また、アルツハイマー病関連バイオマーカーについては、ヒト血液中に極微量しか存在せず従来は測定ができなかったが、近年に開発された超高感度デジタルELISAマシンSimoaにより、アルツハイマー病のコア・バイオマーカーであるATNバイオマーカーの全てを、ヒトあるいはモデル動物の血液中で測定可能となった。これらの技術を用いて、糖尿病患者と非糖尿病患者の血液中のsTREM2濃度およびAβ42/40比、pTau、NfL濃度を全症例で測定し、糖尿病の有無および認知機能障害の重症度と血液バイオマーカーの変動との関連を詳細に検討した。
カスケード最上流に位置する脳内のミクログリア機能低下、糖尿病性認知症の発症機序で最重要
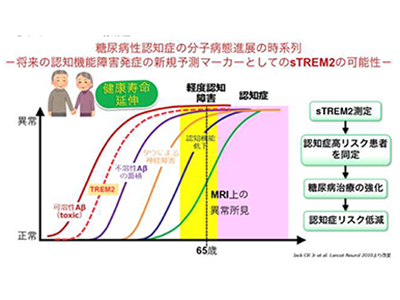
その結果、糖尿病性患者群においては、最も早期のまだ認知機能が正常な時期において、sTREM2の血中濃度が非糖尿病患者群よりも有意に低下していることが判明。さらに、糖尿病患者では、正常からMCI(軽度認知障害)、そして認知症へと認知機能障害が進展するとともに血中sTREM2濃度がさらに減少する一方で、血中Aβ42/40比は変化せず、血中pTau濃度は増加することが判明した。他方、非糖尿病患者群では、認知機能障害の進展とともに、血中Aβ42/40比が低下し、血中pTau濃度が増加するというアルツハイマー病の経過に典型的なパターンを呈していることがわかった。
以上の結果は、これらの血液バイオマーカーについて、これまでは提唱されていなかった糖尿病性認知症に特徴的な、血液バイオマーカーの連鎖的変動(カスケード)があることを示唆している。つまり、糖尿病患者群では、血中sTREM2の低下から始まって、Aβ42/40比の低下を伴わないpTau上昇を呈していた。個々の血液バイオマーカーは、それぞれ脳内のミクログリアおよび病期別のアルツハイマー関連脳病理の進展を反映すると考えられており、これらの血液バイオマーカーの動態から、糖尿病患者の脳内で生じている認知症に関連する複数の病態の時系列が推定できる。それは、脳以外の全身臓器でも炎症治癒過程が遷延するのと同様に、まず脳内のミクログリアの機能が糖尿病によって低下するという病態が最初に生じる。これにより、加齢とともに脳内で増加するAβタンパクを不溶化して老人斑として隔離することでその毒性を軽減するという、ミクログリアが担当している「毒性可溶性Aβの隔離機能」および「老人斑を取り囲んで周囲の脳組織を毒性Aβから保護するというバリア機能」が減弱して、可溶性の毒性Aβが脳組織に拡散する。そして、この毒性Aβによって、タウタンパクの過剰なリン酸化や凝集化などの異常反応が誘導され、異常タウタンパクによる神経細胞障害が惹起され、最終的には認知機能障害を発症するというカスケードだ。
このように、脳内のミクログリア機能の低下が、糖尿病性認知症の発症を惹起する連続的な病的分子機構(カスケード)の最上流に位置しており、糖尿病性認知症の発症機序にとって最も重要で、それに続くアルツハイマー病理変化の発現様式に影響を与えるという仮説が初めて提唱された。
糖尿病性認知症がアルツハイマー病とも連続する新たな認知症の原因疾患となる可能性
今回の研究により、脳内のミクログリア機能の低下が、糖尿病性認知症の発症を惹起する連続的な病的分子機序カスケードの最上流に位置しており、それに続くアルツハイマー病理変化の発現様式に影響を与えるという仮説が初めて提唱された。同成果は、このような糖尿病性認知症の発症・進展の機序の解明につながるのみならず、臨床的にもアクセスしやすく安価な血液検査によって血中sTREM2量を測定することで、認知症発症リスクの高い糖尿病患者を簡便かつ客観的な方法で超早期から同定する方法の開発に貢献できると考えられる。
さらに、糖尿病性認知症に対するミクログリア機能を標的にした新規の治療法の開発や糖尿病患者に対する生活指導・食事指導・運動療法などの介入などの局面においても、血中sTREM2および多項目アルツハイマー病関連血液バイオマーカーは、治療効果の予測やモニタリングに使用することができる。また、すでに臨床的・画像診断的観察から提唱されていた糖尿病性認知症の病態、つまり「脳内のAβアミロイドの沈着が少ないにもかかわらずタウ病理が出現する」という仮説についても、バイオマーカーの観点からAβとタウの上流にミクログリアの機能低下という病態を推定することで、そのような「糖尿病性認知症」の脳病態を説明することが可能となった。糖尿病性認知症については、これまでどのような分子機構でそのような病態が出現するのかは明らかにされておらず、根本的にそのような病態が存在するのかということにも疑念を呈する意見があったが、同研究により「糖尿病性認知症」の発症病態の仮説が体系化された。
「今後、糖尿病性認知症は、アルツハイマー病とも連続する新しい認知症の原因疾患の一つとして、より大規模な臨床研究やモデル動物などの基礎研究により、その疾患概念が確立されていく可能性があり、本研究結果はその扉を開いたと考えている。今後、さらなる研究により、糖尿病性認知症の効果的な予知指標・診断法・治療戦略の開発に取り組んでいきたいと考えている」と、研究グループは述べている。
▼関連リンク
・京都医療センター トピックス




