局所にとどまる膵がん病巣が、なぜ全身性の脂肪分解や体重減少を起こすのか
東京大学医学部附属病院は10月31日、なぜ膵がんでは局所に限局する小さながん病巣であっても体重減少が起きるのかそのメカニズムについて研究を行い、膵がん由来の細胞外小胞には脂肪細胞との接着に重要な接着因子が高発現しており、脂肪細胞に接着した細胞外小胞が脂肪細胞内に取り込まれた結果、脂肪分解が起きることをみいだしたと発表した。この研究は、同病院消化器内科の柴田智華子病院診療医、大塚基之講師、藤城光弘教授らの研究グループによるもの。研究成果は、「Clinical and Translational Medicine」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
がん悪液質はそれ自体が日常の生活動作や生命予後の悪化をもたらすため、そこへの介入法の開発は、がん患者の支持療法を強化するためにも重要な課題である。一方、がんの中でも特に膵がんは、早期の段階から著明な体重減少をきたすことが特徴であるが、なぜ局所にとどまるがん病巣が全身性の脂肪分解や体重減少を起こすのか、その詳細は不明だった。研究グループは、局所にとどまる病巣が全身性に影響を及ぼす要因として、細胞外小胞に着目した。血液中には1mlあたり1,012個程度の細胞外小胞が存在するが、これらの粒子は多彩な生理機能を有していることが知られている。がん細胞も多くの細胞外小胞を血中に放出することから、これが全身の脂肪細胞に働いて脂肪の分解を惹起しているのではないかと仮説を立てた。
膵がん細胞の細胞外小胞、cAMP量以外の要因による脂肪分解
まず、膵がん細胞株を含む培養細胞の上清から単離した細胞外小胞を用いた検討を行った。試験管内で分化させたヒト脂肪細胞に、ヒト正常膵管上皮細胞株HPNE、ヒト膵がん細胞株3種(Panc-1、Miapaca-2、Capan-2)の培養上清から単離した細胞外小胞を添加すると、Panc-1とMiapaca-2の膵がん細胞株の上清から単離した細胞外小胞でのみ有意な脂肪分解を認めた。脂肪分解を起こす因子として重要なcAMPの小胞内の含有量は、各細胞株から単離した細胞外小胞間で差を認めなかったことから、惹起された脂肪分解の差は細胞外小胞内のcAMP量以外の要因が決定づけていることが想定された。同様に健常者血清・膵がん患者血清から単離した細胞外小胞を脂肪細胞に添加すると、膵がん患者血清由来の細胞外小胞で有意に顕著な脂肪分解をきたしたものの、それぞれの細胞外小胞に含有されるcAMP量には差がなく、惹起された脂肪分解の程度の差はやはり細胞外小胞内のcAMP量以外の要因が考えられた。
細胞外小胞の脂肪細胞への取り込みの差が、脂肪分解の程度の差と関連
次に、蛍光ラベルした細胞外小胞を用いた検討で、Panc-1由来の細胞外小胞は脂肪細胞によく取り込まれるものの、Capan-2由来の細胞外小胞はほとんど取り込まれなかったことから、脂肪分解の程度の差は細胞外小胞の脂肪細胞への取り込みの差によるのではないかと考えた。そこで、Panc-1由来の細胞外小胞のin vivoでの分布を追跡するために、Panc-1由来の細胞外小胞内に人工的なペプチド配列を含有したレポーター小胞を作成して、マウスの尾静脈から静脈注射し各臓器への分布を確認した。その結果、Panc-1由来の細胞外小胞は、脂肪や肺への取り込みが多いものの、骨格筋や肝臓への取り込みは少ないことがわかった。
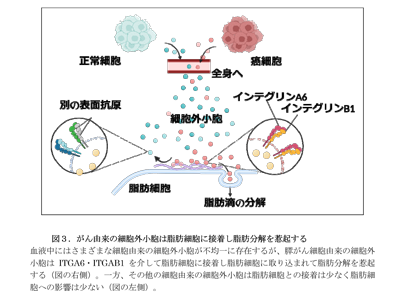
脂肪分解を起こす膵がん細胞株由来の細胞外小胞だけに高発現するインテグリンを発見
「細胞外小胞の表面上に発現する接着因子のインテグリンの種類が、細胞外小胞の組織分布を規定する」という既報を参考に、膵がん細胞株由来の細胞外小胞に発現するインテグリンの種類を検討したところ、脂肪分解を起こすPanc-1やMiapaca-2由来の細胞外小胞にはインテグリンα6(ITGA6)・β1(ITGB1)・αV(ITGAV)が高発現しているのに対し、脂肪分解を起こさないCapan-2の細胞外小胞にはITGB1は発現していなかった。ITGB1とITGA6が対合したインテグリンα6β1はラミニンに結合するインテグリンであるが、脂肪組織や肺にはラミニンが高発現しているものの骨格筋や肝臓ではその発現が少ないことから、インテグリンα6β1とラミニンの相互作用が膵がん由来の細胞外小胞の脂肪組織への伝播を促進させ、その結果、脂肪分解が惹起される可能性が考えられた。実際に、Panc-1由来の細胞外小胞を脂肪細胞に添加すると脂肪細胞の表面に多数の小胞が接着するが、ITGB1を遺伝子編集でノックアウトした細胞外小胞ではほとんど接着しないことが、Nanosuit法を用いた電子顕微鏡観察で確認できた。
がん由来の細胞外小胞のみを特異的に単離して解析する方法を確立
ここまでの結果から、膵がん由来の細胞外小胞はITGB1とITGA6を高発現していることが多く、その結果として脂肪細胞へ伝播しやすいことが膵がん患者で高度な脂肪分解が起きる一つの要因ではないかと考えられた。しかしながら「健常者の血液中の細胞外小胞と膵がん患者の血液中の細胞外小胞ではこれらのインテグリンの発現量には差がない」という既報もあった。この不一致を説明するためには、従来行われているような血液中の細胞外小胞の集団を一括で解析する手法ではなく、がん由来と考えられる細胞外小胞だけを特異的に単離して解析する必要があると考えた。そこで、膵がんの血清マーカーとして臨床的によく使われている糖鎖抗原CA19-9に着目し、膵がん由来の細胞外小胞にもCA19-9が発現していることを確認後、抗CA19-9抗体を用いた免疫沈降法によってCA19-9を持つ膵がん細胞由来の細胞外小胞のみを単離濃縮する方法を確立した。その結果、血中の細胞外小胞を一括で解析したときに比べて、がん由来の細胞外小胞を対象とした解析では、ITGB1とITGA6を発現する細胞外小胞の割合が有意に多いことを確認できた。
以上の結果から、膵がん由来の細胞外小胞の表面にITGB1とITGA6が高発現していることが脂肪分解惹起に重要であることが示されるとともに、がん由来の細胞外小胞のみを特異的に単離して解析すると、不均一な細胞外小胞集団を一括解析するだけではわからなかった精緻な結果が得られることが示された。「今後、このような特異的な細胞外小胞の単離解析とそこへの介入法開発を進めることで、病態に関わる新たな知見の取得や新たな治療法の創生につながる可能性がある」と、研究グループは述べている。
▼関連リンク
・東京大学医学部附属病院 プレスリリース



