FUSが制御するSYNGAP1、ALSの原因となりうるか?
名古屋大学は10月20日、iPS細胞由来運動神経を用いて、筋萎縮性側索硬化症(ALS)の発症に関わる新たなメカニズムを解明したと発表した。この研究は、同大大学院医学系研究科神経内科学の横井聡特任助教(筆頭著者)、勝野雅央教授、愛知医科大学の祖父江元学長、加齢医科学研究所神経iPS細胞研究部門/内科学講座(神経内科)の岡田洋平教授らの研究グループによるもの。研究成果は、「Journal of Neuroscience」電子版に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
ALSは、上位および下位運動ニューロンが選択的かつ進行性に変性、脱落していく希少神経難病。全身骨格筋の進行性の筋萎縮と筋力低下による運動機能障害や、嚥下障害、呼吸筋麻痺などを呈し、急速な進行の末に平均3~5年で死亡または長期の人工呼吸器装着が必要となる。ALSに対してはこれまでに幾多の薬剤の臨床試験が行われているが、現時点では軽微な効果を示すリルゾールとエダラボンの2種類が薬事承認されているのみ。ALSの治療法開発が難航している理由の1つは、ALSがなぜ起こるのか、その病態がいまだに明らかになっていないからだ。そのため、治療薬を開発するには基礎研究でALSを発症する詳細なメカニズムを明らかにすることが重要かつ急務な課題となっている。
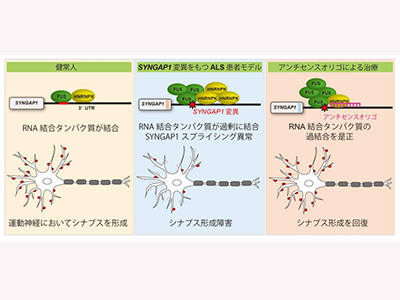
研究グループはマウスモデルを用いた先行研究により、ALSの原因となるRNA結合タンパク質であるFused in sarcoma(FUS)が、シナプス機能に重要な役割を果たすタンパク質SYNGAP1のRNAを制御していることを発見している。その知見に基づき、SYNGAP1がALSの原因となりうるかを研究した。
SYNGAP1の新規変異、RNA結合タンパク質の過剰結合でスプライシング異常を引き起こす
まず、日本のALS患者データベースであるJaCALSに登録された遺伝子情報の解析により、ALS患者の約1%にSYNGAP1の新規変異を同定。この新規変異がALSを引き起こすかを調べるために、健常者iPS細胞に遺伝子編集技術CRISPR-Cas9を用いてSYNGAP1変異を導入し、運動神経に分化させてその影響を解析した。その結果、この新規変異はSYNGAP1のRNAにFUSとHeterogeneous nuclear ribonucleoprotein K(HNRNPK)という2種類のRNA結合タンパク質を過剰に結合させ、SYNGAP1のスプライシング異常を引き起こすことを見出した。
アンチセンスオリゴ投与で、変異によるスプライシング異常是正・シナプス回復
また、SYNGAP1タンパク質のアイソフォームを変化させ、運動神経のシナプス形成を障害することがわかった。特に、HNRNPKが過剰に結合していることが運動神経の異常に強く関わっていたため、HNRNPKの過剰結合をブロックする核酸アンチセンスオリゴを投与。その結果、変異によるスプライシング異常が是正され、シナプスが回復した。
ALS新規治療薬開発の可能性を見出す
今回の結果から、RNA結合タンパク質の過剰結合という新たなメカニズムがALS発症に関与していることが明らかになった。また、今回開発したアンチセンスオリゴのように、詳細な発症機序に基づいたALSに対する新たな治療薬開発の可能性を見出した。RNA結合タンパク質が引き起こすALSの発症原因をさらに明らかにすることで、ALS患者に広く応用できるような治療薬開発を進めていく、と研究グループは述べている。(QLifePro編集部)
▼関連リンク
・名古屋大学 プレスリリース




