さまざまな疾患との関連が報告されるミトコンドリア、脳腫瘍との関わりは?
九州大学は10月14日、悪性脳腫瘍の生体環境と考えられる糖飢餓状態において、腫瘍細胞はエネルギー産生をミトコンドリアに強く依存することを発見し、ミトコンドリアを標的とした治療およびそのメカニズムを解明したと発表した。この研究は、同大学院医学研究院保健学部門検査技術科学分野の内海健教授(責任著者)、八木美佳子助教、同院臨床検査医学分野の康東天名誉教授、博士課程3年の三木健嗣(筆頭著者)、同院脳神経外科の吉本幸司教授らの研究グループによるもの。研究成果は、「Oncogenesis」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
悪性脳腫瘍の平均余命はわずか2年以内と極めて予後が悪く、脳腫瘍の11%を占める膠芽腫は、5年生存率が約10%と非常に悪性度が高い疾患である。現在テモゾロミドという薬剤が広く使用されているが、余命をわずか数か月延ばす効果があるのみとされている。これまでに多くの研究が行われているが、根本的治療となる有効な治療はない。
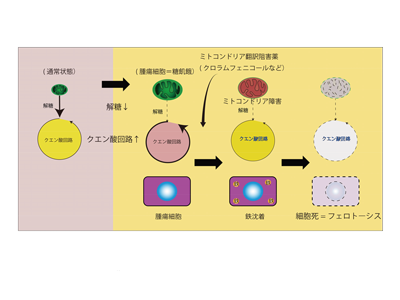
腫瘍細胞の増殖速度は著しく早く、周囲の正常脳にも浸潤する。研究グループは、この増殖能力の一因として、正常細胞が増殖することができない低血糖、低栄養など劣悪な環境でも増殖でき、代謝が変化しているのではないかと考え、代謝に着目した。なかでも、ミトコンドリアは生体において代謝を行う主な小器官の一つとして考えられている。以前は、エネルギー産生の小器官として知られていたが、最近ではがんを含めたさまざまな疾患との関連が報告されている。研究グループは、悪性脳腫瘍の治療について、ミトコンドリアが鍵になると考え研究を進めた。
糖飢餓状態の腫瘍細胞に対し、クロラムフェニコールが抗腫瘍効果
一般に悪性腫瘍における腫瘍の生態環境は血糖飢餓、低酸素であるといわれており、脳腫瘍においても糖やアミノ酸が飢餓状態にあると報告されている。そのため生体内の環境に準じた糖飢餓状態に腫瘍細胞をおき代謝変化を解析したところ、ミトコンドリア関連タンパク質の発現が増加しており、酸化的リン酸化の活性が上昇していることがわかった。
糖飢餓状態における細胞の生存にはミトコンドリアが重要であると考えられたため、飢餓状態においてミトコンドリア翻訳阻害薬(クロラムフェニコールやドキシサイクリン)を用いたところ、糖飢餓状態では強く抗腫瘍効果を認めた。
メカニズムは、鉄が蓄積することで起こるフェロトーシス
また、なぜクロラムフェニコールを用いて細胞死が起こったのか検討したところ、鉄および過酸化資質の蓄積を認め、フェロトーシスによる細胞死が起こっていることが判明した。
ドラッグリポジショニングによる実用化に期待
今回の研究で重要な点は、ミトコンドリア翻訳阻害薬としてすでに市販されている、クロラムフェニコールを用いて抗腫瘍効果を確認したことである。クロラムフェニコールは抗生剤であり、正常細胞には悪影響を与えず細菌のみを標的としており、脳への移行性(髄液移行性)がよいため生体への効果が期待できる。また、すでに使用されている薬剤のためドラッグリポジショニングが期待でき、実用化までが迅速であることが予想される。「今後、生体での投与量や効果について検証し、新しい有望な治療法となることが期待できる」と、研究グループは述べている。
▼関連リンク
・九州大学 研究成果



