膨大なネットワークを形成するRAS、単独を標的にしてもRAS変異がんの排除は困難
岐阜大学は10月13日、大腸がん・膵臓がんで高頻度に変異しているRASネットワークについて詳細にその機構を明らかにし、そのネットワークを阻害するマイクロRNA核酸医薬シーズの開発に世界で初めて成功したと発表した。この研究は、同大大学院連合創薬医療情報研究科の杉戸信彦特任助教、赤尾幸博特任教授らの研究グループによるもの。研究成果は、「Molecular Therapy-Nucleic Acids」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
RAS変異は最上位のドライバー癌遺伝子であり、これまでのがんゲノム解析からヒトのがんの約30%にRAS遺伝子の変異が観察されている。特に、ヒトの大腸がんで約40%、膵臓がんで約90%に観察され、悪性度に寄与している。RASは10を超える下流のシグナルを制御することで膨大なネットワークを形成している。特に、PI3K/AKTとMAPK/ERKシグナルは細胞の増殖・生存に関する遺伝子の転写を誘導する重要なシグナル伝達経路となっている。そこで、RAS阻害剤の開発が世界規模で30年以上にわたり行われてきた。近年、ようやくRASの一つの変異にのみ有効な化合物が医薬品として使われるようになったが、そのRAS阻害剤も高頻度で薬剤耐性が獲得されることが報告され、一時的な効果しか見込めない。RASのみ阻害しても増殖抑制は一時的であり、RASネットワークにより代償性シグナルが活性化され、即時にその阻害はキャンセルされる。そのため、RAS単独を標的にしてもRAS変異がんを排除することは困難である。
RASネットワークを包括的に抑制するマイクロRNA、化学修飾により活性を強化
研究グループは、2006年よりRASおよびRASネットワークを包括的に抑制するmicroRNA(miRNA)の研究を開始しており、RASシステムを破綻させる主要なmiRNAがmiR-143であることを明らかにしていた。miR-143は、多くのがんにおいてその発現が正常組織と比較して低下しているがん抑制miRNAである。miR-143はRASのみならずその下流の増殖を誘導するシグナル系(エフェクターシグナル)PI3K/AKTとMAPK/ERKのAKTおよびERKを標的にし、相乗的にこれらのシグナルを抑制することがわかった。しかしながら、市販のmiR-143では活性が弱く、臨床応用を見据えた化学修飾miR-143の開発が必要だった。研究グループは、これまでに化学修飾を施したmiR-143#12の開発に成功し、各種RAS変異がんに対する効果を報告していた。
これまで知られていないRASネットワークの詳細が明らかに
研究では、miR-143#12の抗がんメカニズムの有用性について、RAS変異がんを対象に明らかにした。その結果、開発されたmiR-143#12は、100を超えるmiR-143誘導体の中で最もヌクレアーゼに耐性があり、抗がん活性はヒト大腸癌細胞株DLD-1において市販のmiR-143の数十倍であることがわかった。miR-143#12はガイド鎖にさまざまな化学修飾をしており、多くのmiR-143誘導体の中で卓越した活性を有していた。
強力な抗がん活性をもつmiR-143#12を用いることで不活性型RAS/GDPから活性型RAS/GTPに変換するSOS1も標的にしていること、さらにRASエフェクターシグナルの標的遺伝子がRAS自身であること、つまりRAS正の制御回路の存在が明らかになった。RAS変異大腸癌ではEGFRやAKT、MAPKに対する分子標的薬の効果は代償性のカスケードが働くため一過性であり期待出来ない。miR-143#12はこれまで明らかにできなかった詳細なmiR-143/RASカスケードを明らかにした。
動物実験において低用量で顕著な抑制効果、正常な血管新生を誘導かつ自身の効果も増強
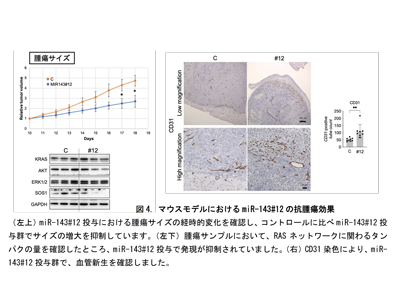
ヒト大腸がん細胞を皮下に移植したヌードマウスにmiR-143#12を局所投与した結果、低用量で顕著な腫瘍増殖抑制が示された。投与されたマウス腫瘍サンプルにおけるタンパク発現では、RASネットワーク(RAS、AKT、ERK、SOS1)の発現が低下していた。in vitro(試験管内)実験でのmiR-143#12の効果は動物実験でも実証された。さらに、新たな知見として、血管のマーカーであるCD31で腫瘍サンプルを染色すると、miR-143#12の浸透したであろう部位で顕著に染色が確認された。つまり、miR143#12は正常な血管新生を誘導し、自身の効果を増強した可能性が示唆された。
今回の研究から、がん化に最も重要な役割を果たしているドライバー遺伝子であるRASの変異を有するがんの根治には、RAS、AKT、ERKそれぞれを単独阻害しても不十分であり、開発された化学修飾miR-143#12による複合的なRASネットワークの抑制が最適であることが明らかになった。さらに、マウスモデルにおいて血管新生が観察され、それに伴った低濃度での抗腫瘍効果が示された。「今後、miR-143#12の効果が全身投与で反映される薬剤送達システムの開発が望まれる」と、研究グループは述べている。
▼関連リンク
・岐阜大学 研究・採択情報



