肺がんのEGFR変異、薬剤耐性の克服法はいまだ見つからず
国立がん研究センターは10月7日、日本人を含むアジア人の肺腺がんの半数を占めるEGFR遺伝子変異のある肺がんの薬剤耐性機序としての融合遺伝子を包括的に調べ、実際に薬剤耐性の原因となっているものとそうでないものの見分け方と克服するための有効な併用療法を、患者治療および細胞実験により提唱したと発表した。この研究は、米国Dana-Farber Cancer InstituteのDr. Pasi A. Jänne氏、国立がん研究センター研究所分子病理分野の小林祥久研究員を中心とした国際共同研究グループによるもの。研究成果は、「Nature Communications」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
肺がんは最も死亡者数の多いがん種である。肺腺がんのうち、日本人を含むアジア人の半数、欧米人の約20%でEGFR遺伝子の活性型変異が見られる。進行期および再発のEGFR遺伝子変異肺がんには、第三世代EGFRチロシンキナーゼ阻害剤(オシメルチニブ)が標準治療となっているが、約1~2年で薬剤耐性を獲得して効かなくなってしまうことが問題となっている。これまでに薬剤耐性機序として、「薬剤結合ポケットの構造変化で薬が結合できない(例:EGFR C797S二次変異)」「EGFR遺伝子以外の他の発がん遺伝子の変異・遺伝子増幅・融合遺伝子からの発がんシグナルが出る」「腺がんから他の種類の病理組織への転換(小細胞がん、扁平上皮がん)」などが報告されているが、研究段階で、その克服法として標準治療化されたものはまだ存在しない。
次世代シークエンサーでも技術的に融合遺伝子の検出は困難
DNAはエクソンとイントロンが交互に繰り返される配列をしている。DNAからmRNAに転写されてアミノ酸配列へと翻訳される過程の途中で、イントロンを除去してエクソンだけをつなぎ合わせるスプライシングが起こる。融合遺伝子の多くは、そのbreakpoint(切断点)がイントロンに位置している。DNA配列を解析するための次世代シークエンサーの技術が発達してきているが、特に以下の2つの理由から融合遺伝子の検出は技術的に困難なことが多いのが現状だ。
1つは、患者の治療につながる遺伝子変異を検出するためのパネル(解析対象となる遺伝子領域のセット)には、あらかじめエクソンのホットスポット変異が標的として設定されており、イントロンは標的に含まれていないことが多いこと。もう1つは、イントロンには繰り返し配列が散見され、次世代シークエンサーで読まれた100から200塩基程度の長さの配列からどの遺伝子のイントロンの一部であるかを同定することが困難なことが多いことである。
融合遺伝子のうち、実際に薬剤耐性の原因となっているのは一部と判明
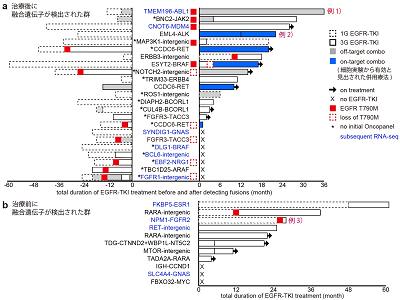
研究グループはまず、504人のEGFR遺伝子変異のある肺がん患者のDNA検体を次世代シークエンサー(あらかじめ設定されていない標的遺伝子も広く検出できるハイブリッドキャプチャー)で解析した。その結果、104種類の融合遺伝子候補が検出された。がんに関連する遺伝子のタイプには、がんを引き起こす発がん遺伝子や、がんを抑えるがん抑制遺伝子などがあるが、薬剤耐性を起こしやすく、なおかつ、薬剤で治療標的になりやすいという観点から、発がん遺伝子を含む融合遺伝子37個についてさらに解析を進めた。
実際の患者の治療経過や、スプライシングによってイントロンが除去された後のRNAを解析することで新規発がん融合遺伝子TMEM87A-RASGRF1の発見に成功した実績のあるRNAシークエンス、CRISPR-Cas9ゲノム編集細胞モデルを使った実験データの3つのアプローチを統合することで各融合遺伝子の役割を調べたところ、薬剤耐性としての機能をもつ融合遺伝子は一部でしかないことがわかった。
一例として、第一世代EGFR阻害剤(1G EGFR-TKI)で1年治療後、白血病の原因として有名なABL1遺伝子を含む融合遺伝子「TMEM196-ABL1」が検出されたにもかかわらず、その後第三世代(3G)EGFR-TKIによる治療が3年続いたことから、この融合遺伝子には薬剤耐性の役割がないと判断できる。
ESYT2-BRAFなどの融合遺伝子を作製し、それぞれの融合遺伝子に効く薬を同定
EGFR遺伝子変異のある肺がん患者が薬剤耐性として融合遺伝子を獲得した状況を模して、CRISPRゲノム編集技術を応用することでEGFR遺伝子変異のある肺がん細胞株からESYT2-BRAFなどの融合遺伝子を作製した。これらのモデルがEGFR阻害剤に耐性となることを確認し、薬剤スクリーニングによってそれぞれの融合遺伝子に効く薬を同定した。
EGFR遺伝子側、融合遺伝子側、共通のシグナル経路、新規など、耐性機序にさまざまな原因
がんはあらゆる治療に対してさらなる薬剤耐性を獲得してしまうため、融合遺伝子に効く薬剤とEGFR阻害剤の併用療法で長期間細胞モデルを培養することで薬剤耐性株を樹立し、その耐性機序を解析した。その結果、EGFR遺伝子側の耐性機序(EGFR Side)、融合遺伝子側の耐性機序(Fusion side)、共通のシグナル経路の耐性機序(Down stream)、新規耐性機序(Other)などさまざまな原因で耐性となることがわかった。さらなる細胞実験により、これらのさまざまな耐性機序を克服するために有効な薬剤もそれぞれ同定した。
研究・臨床の両面からのさらなる研究が必要
融合遺伝子という現象は複雑であるため、正しく検査で見つけること自体が困難だ。しかし、今回の研究を含むこれまでの研究から、正しく見つけることができれば、ALK阻害剤やRET阻害剤などすでに保険承認されている薬とEGFR阻害剤の併用療法が、実際に患者のがんに効くことが研究段階で示されている。
研究では、DNAを使った次世代シークエンス、RNAシークエンス、臨床情報、細胞実験など、病院と研究所の総力戦で治療標的となる融合遺伝子の検出に挑んだが、個々の患者に対して行うことは非現実的であるため、将来的には単一の検査で治療標的となる融合遺伝子を正しく検出できる方法の開発が求められる。さらに次のステップとして、その検査の結果に応じて有効な併用療法の効果を評価する臨床試験を行うことで、治療法の保険収載・実臨床での患者の治療につながると期待される。「融合遺伝子の克服には、研究・臨床の両方の面からのさらなる研究が必要だ」と、研究グループは述べている。
▼関連リンク
・国立がん研究センター プレスリリース




