グリオーマ幹細胞の多様な遺伝子異常や浸潤性・治療抵抗性を踏まえた治療法開発が求められていた
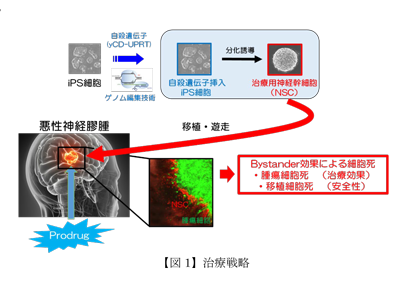
慶應義塾大学は10月3日、ゲノム編集技術を用いてiPS細胞に治療遺伝子を組み込み、治療用の神経幹細胞(Neural stem cell:NSC)に誘導後、脳内に移植することにより、難治性の悪性神経膠腫(グリオーマ)幹細胞(Glioma stem cell:GSC)モデルマウスに対して顕著な抗腫瘍効果を示すことを明らかにしたと発表した。この研究は、同大医学部脳神経外科学教室の戸田正博教授らの研究グループによるもの。研究成果は、「Bioengineering & Translational Medicine」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
グリオーマは悪性の脳腫瘍の一つで、まわりの組織に広がり多様な遺伝子異常や浸潤性・治療抵抗性の幹細胞であるGSCの存在により、極めて予後不良な疾患である。手術や化学・放射線療法を駆使しても根治は困難であり、その生物学的特性を踏まえた新たな治療法の開発が求められている。研究グループはこれまで、ヒトiPS細胞由来のNSCが浸潤性のGSCに向かって移動するさまざまなメカニズムを解明し、NSCを薬剤や治療遺伝子の「運び屋」として用いる治療開発研究を進めてきた。
開発した治療用NSC、GSCモデルマウスに高い抗腫瘍効果、プロドラック投与により自滅させることも可能
ヒトiPS細胞に導入する治療遺伝子として、融合自殺遺伝子「yeast cytosine deaminase –uracil phosphoribosyl transferase(yCD-UPRT)」を選定した。yCD-UPRT遺伝子は、プロドラックである抗真菌剤5-Fluorocytosine(5-FC)を抗腫瘍剤5-Fluorouracil(5-FU)に変換する酵素の遺伝子である。一方、iPS細胞は導入された遺伝子発現が減弱しやすく、また、ウイルスベクターを用いて遺伝子導入した場合、染色体にランダムに自殺遺伝子が挿入されるため、その周辺遺伝子の不活性化、腫瘍化などのリスクが生じる。
そこで研究グループは、CRISPR/Cas9ゲノム編集技術を用いてさまざまな検討を行い、恒常発現可能な遺伝子挿入部位の同定に成功した。その結果、遺伝子導入iPS細胞から分化誘導することにより、治療用NSCの安定供給が可能になった。治療用NSCを脳内に移植すると、広範囲に浸潤したGSCの近くへ移動し、一定期間後にプロドラックを投与すると治療用NSCが自滅すると同時に5-FUを放出し、周囲の腫瘍細胞を殺傷する。実際に、治療用NSCは、GSCモデルマウスに対して高い抗腫瘍効果を示した。以上から、自殺遺伝子yCD-UPRTを導入した治療用NSCの安定供給とその有効性を証明することができた。同治療法は、移植NSC自身も自滅するため、NSC自身の腫瘍化リスクも回避できる。
今後の遺伝子細胞療法を開発するための基盤技術にも
開発された方法は、幹細胞治療と遺伝子治療を組み合わせた新規の治療法であり、今後の遺伝子細胞療法を開発するための基盤技術になるという。「現在、国産技術のゲノム編集法を用いてiPS細胞にCD-UPRT遺伝子を組み込み、臨床グレードの治療用NSCの作製準備を行っている。難治性疾患の悪性神経膠腫の予後改善を目指して、できるだけ早期に臨床治験の開始ができるよう、一層尽力していく」と、研究グループは述べている。
▼関連リンク
・慶應義塾大学 プレスリリース






