腫瘍組織に豊富に存在するTGF-β、「促進」と「抑制」相反する作用の関連は未解明
東京医科歯科大学は9月28日、口腔がんの転移の原因が、トランスフォーミング増殖因子(TGF-β)により発現が上昇するケラチン結合因子(KRTAP2-3)の作用で誘導される上皮間葉移行(EMT)であることをつきとめたと発表した。この研究は、同大大学院医歯学総合研究科病態生化学分野の渡部徹郎教授、井上カタジナアンナ助教、高橋和樹連携研究員、東京大学大学院医学系研究科の宮園浩平教授、大阪大学大学院歯学研究科の内橋俊大講師、大阪大学蛋白質研究所の岡田眞里子教授、和歌山県立医科大学医学部の橋本真一教授、東京医科歯科大学大学院医歯学総合研究科の三浦雅彦教授らの研究グループによるもの。研究成果は、「Cell Reports」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
がん細胞は正常細胞が無限の増殖能を獲得することにより生じ、さらに運動・浸潤能を獲得することで、全身に転移し患者の生命を奪う。多くの抗がん剤は細胞増殖を標的としているが、がんによる死亡の9割が転移に関連していることを考えると、がんの進展におけるがん細胞の運動・転移能の獲得機構の解明は急務である。腫瘍組織に豊富に存在するTGF-βはEMT誘導を介した運動能亢進という「がん促進作用」と細胞周期をG1期に停止させることによる増殖低下という「がん抑制作用」を持っているが、その相反する2つの作用の関連性については未解明だった。
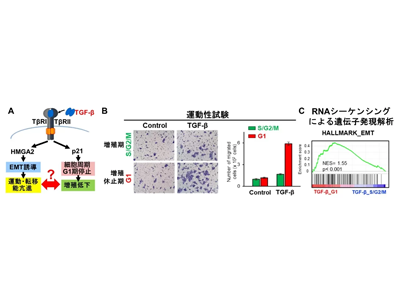
TGF-βにより増殖が停止した細胞では新たなEMT経路が誘導される
そこで研究グループは、細胞周期をモニタリングできるFucciシステムを用いてG1期に移行して増殖が低下した細胞とS/G2/M期に存在する増殖している細胞をFACSで分取して運動性試験とRNAシーケンシングを行ったところ、TGF-βにより増殖が停止した細胞の運動性が高く、EMTが誘導されていることを見出した。さらに、シングルセルRNAシーケンシングによる解析により、TGF-βにより誘導されるEMTには従来報告されていたHMGA2転写因子発現を介するものに加えて、細胞周期がG1期に停止した細胞を形成する新たな経路が存在することを見出した。
KRTAP2-3はTGF-βの2つの作用を制御する実行因子
この現象の機序を解明するため、TGF-βによりG1期の細胞において発現が上昇する因子としてKRTAP2-3を同定し、KRTAP2-3がこの新たなEMT経路を誘導することを明らかにした。これまでKRTAP2-3の機能に関する報告はないが、KRTAP2-3が頭頸部がん患者の予後不良因子であり、がん細胞において発現させると増殖を抑制し、運動能を亢進することから、TGF-βの2つの作用を制御する実行因子であることを見出した。さらにKRTAP2-3遺伝子を欠損させた口腔がん細胞は、マウスへの同所移植モデルにおいてリンパ節転移が低下し、EMTの逆転現象であるMETが生じることから、KRTAP2-3が口腔がん細胞の増殖を抑制しつつ、EMT誘導を介して運動・転移能を亢進する新規因子であり、治療標的として有望であることが示された。
頭頸部がんや胃がんの病態解明と新規治療法開発への応用にも期待
今回の研究により、TGF-βにより増殖能が低下した細胞の運動・転移能が上昇するというこれまでのがん生物学におけるパラダイムを大きく変える知見が得られた。この現象の機序を解明する過程で、TGF-βにより誘導される新規EMT制御因子として同定されたKRTAP2-3は頭頸部がん患者の予後不良因子であり、口腔がん細胞のEMT誘導を介して運動・転移能を亢進することから、KRTAP2-3の発現・機能を阻害することにより、口腔がんの転移を抑制できることが予測されるという。「KRTAP2-3の発現は正常組織では毛髪のみに限局しており、頭頸部がんや胃がんなどのがん細胞において上昇することから、新たな治療標的として期待される」と、研究グループは述べている。
▼関連リンク
・東京医科歯科大学 プレスリリース




