老化関連疾患の発症に関わる「免疫老化」のメカニズムの全容は不明
京都大学は9月22日、SA-T細胞が慢性炎症や自己抗体の産生を引き起こすメカニズムを解明し、それを人為的に阻害することにより免疫老化や自己免疫疾患を抑制できることを、動物モデルで明らかにしたと発表した。この研究は、同大大学院医学研究科の福島祐二特定助教、服部雅一特定教授らの研究グループによるもの。研究成果は、「Cell Reports」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
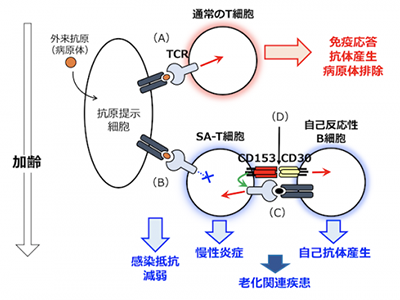
ヒトは加齢に伴い、がん、糖尿病、動脈硬化症、慢性腎不全などの慢性炎症性疾患、あるいはリウマチ性自己免疫病など多様な疾患を発症しやすくなる。これらの「老化関連疾患」の発症には「免疫老化」と言われる加齢に伴う特徴的な免疫系機能変化が基礎にあると考えられているが、そのメカニズムの全容は不明だ。マウスでは、加齢に伴って「老化関連T細胞(SA-T細胞)」と呼ばれる若齢個体には存在しない特異なT細胞が増加し蓄積してくることがわかっている。
加齢に伴うSA-T細胞の増加に、CD153とCD30の機能的相互作用が関与
SA-T細胞は正常T細胞と異なり、T細胞抗原受容体(TCR)を介する増殖・活性化反応を示すことができないが、他方で、大量の炎症性因子を分泌し得るという老化細胞の特徴を持っている。
研究グループは、遺伝子欠損マウスを使った実験を実施。その結果、加齢に伴うSA-T細胞の増加には、SA-T細胞に発現される「CD153分子」と、ごく少数の自己反応性B細胞に発現される「CD30分子」とのユニークな機能的相互作用が関与していることが判明した。
SA-T細胞と自己反応性B細胞は相互に刺激し合い、活性化されて増殖
CD153とCD30の相互作用により、SA-T細胞はTCRを介する増殖・活性化反応を回復するとともに、自己反応性B細胞は増殖分化して自己抗体を産生するようになる。つまり、CD153とCD30の双方向性シグナルによって、SA-T細胞と自己反応性B細胞は相互に刺激し合い、活性化されて増殖してくることがわかった。
17D抗体投与で、マウスSLEの発症予防・治療効果、生存率の改善を確認
実際に、CD153とCD30の相互作用を遮断する抗体(17D)を作出してマウスに投与したところ、加齢に伴うSA-T細胞の増加と、それに伴う自己抗体や炎症因子の増加はともに有意に抑制されることが示された。
自己免疫疾患の全身性エリテマトーデス(SLE)を発症し、腎不全により死亡するモデルマウスでは、早期から著明なSA-T細胞の増加が認められることがわかっている。そこで、17D抗体をこのマウスに投与したところ、SLE病態の強い発症予防および発症後の治療効果が認められ、明らかな生存率の改善効果が得られることがわかったという。
多様な老化関連疾患の抑制への貢献に期待
近年の研究により、SA-T細胞は健常個体の加齢により増加してくるだけでなく、高脂肪食による糖尿病、種々の要因による慢性腎不全など、多様な組織ストレスに伴う慢性炎症性疾患において著明に増加し、病態発生に関与していることが示唆されてきている。今回の研究成果により、SA-T細胞増加に代表される免疫老化が、感染抵抗性などの減弱だけでなく、多様な慢性炎症性疾患やリウマチ性疾患の発症にも重要な役割を果たすことが明らかにされた。
「今後、ヒトのSA-T細胞を標的とした創薬研究によって、進行する高齢化社会においてますます有病率が増加しつつある多様な老化関連疾患の抑制に貢献することが期待される」と、研究グループは述べている。
▼関連リンク
・京都大学 最新の研究成果を知る




