新型コロナウイルスによる「血管内皮バリア破壊」のメカニズムは不明だった
京都大学iPS細胞研究所(CiRA)は9月22日、新型コロナウイルス(SARS-CoV-2)が、血管内皮細胞間の密着結合に関わるClaudin-5(CLDN5)の発現を抑制することで血管内皮バリアを破壊し、血管内へと侵入することを明らかにしたと発表した。この研究は、CiRA増殖分化機構研究部門の橋本里菜研究員、高橋潤也大学院生(大阪大学大学院薬学研究科 臨床薬効解析学分野)、CiRA同部門の高山和雄講師、岡田欣晃准教授(大阪大学同分野)らの研究グループによるもの。研究成果は、「Science Advances」にオンライン公開されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
血管内皮細胞は、SARS-CoV-2感染受容体であるアンジオテンシン変換酵素2(ACE2)の発現量が少ないため、SARS-CoV-2にほとんど感染しない。しかし、COVID-19患者では、血管炎や血管内皮バリア破壊が観察される。血管内皮バリアが破壊されるとSARS-CoV-2が血管を介して呼吸器から他臓器へ移動するのを促進するだけでなく、肺の血管外への免疫細胞や血液成分の浸潤を促し、肺炎や急性呼吸窮迫症候群(ARDS)などの重症病態を誘発する。SARS-CoV-2による血管内皮バリア破壊は、COVID-19患者において阻止すべき重大な問題だが、そのメカニズムはほとんど解明されていない。
そこで研究グループは今回、SARS-CoV-2に感染させた気道チップのヒト肺血管内皮細胞(HMVEC-L)の包括的な遺伝子発現を解析し、SARS-CoV-2による血管内皮バリア破壊に寄与する遺伝子としてCLDN5を特定。さらに、CLDN5の機能解析を進めるとともに、CLDN5がCOVID-19の創薬ターゲットになり得るか検討した。
気道チップを用いて、SARS-CoV-2による血管内皮バリア破壊の再現に成功
まず、SARS-CoV-2による血管内皮バリアの破壊および呼吸器から血管への移行を模倣するため、気道チップを使用した。気道チップは気道上皮細胞(線毛細胞、クラブ細胞、杯細胞、基底細胞)とHMVEC-Lで構成され、気道チャネルおよび血管チャネルにそれぞれ空気と培地を流すことにより、気道における微小環境を再現できる。
気道チャネルにおけるウイルスゲノム量は感染4日目にピークに達する一方で、血管チャネルでは3日目に増加し始め、感染7日目でピークに達した。以上のように、気道チップを用いることにより、SARS-CoV-2が気道から血管へ漏出する様子を再現することに成功した。
SARS-CoV-2<HMVEC-LのCLDN5発現抑制<VE-cadherin局在変化<血管内皮バリア破壊
遺伝子発現を包括的に調べたところ、感染した気道チップのHMVEC-Lにおいては、細胞接着関連遺伝子発現が減少していた。特定した細胞接着関連遺伝子のうち、CLDN3、CLDN5、PCDHB1、PCDHB8、IGSF9Bの遺伝子発現が顕著に減少していたという。さらに、これらのうち、CLDN5の内因性遺伝子発現量が最も高いことが示された。以上のことから、CLDN5はSARS-CoV-2による血管内皮バリア破壊の原因遺伝子である可能性が示唆された。
感染した気道チップ上のHMVEC-L間の結合部でのCLDN5タンパク質の減少も観察された。VE-cadherinタンパク質の発現量は感染により変化しなかったが、接着結合が破壊され、細胞間に隙間が確認された。以上のことから、SARS-CoV-2がHMVEC-LにおいてCLDN5の発現を抑制し、VE-cadherinの局在を変化させることで、血管内皮バリアを破壊することが示された。
CLDN5の過剰発現やフルバスタチンの作用で、SARS-CoV-2によるバリア破綻を抑制
さらに研究グループは、ドキシサイクリン(DOX)作用により、CLDN5の発現量が上昇するHMVEC-Lを作製した。CLDN5の過剰発現は、SARS-CoV-2の血管チャネルへの侵入およびVE-cadherinを介した細胞間接着の減弱を防止した。以上の結果から、HMVEC-LにおけるCLDN5の過剰発現が、SARS-CoV-2による血管内皮バリア破壊を抑止することが示された。
スタチン治療によりCOVID-19患者の死亡率が低下することが報告されている。スタチンの一種「シンバスタチン」は、肺動脈内皮細胞におけるCLDN5発現を増加させることにより、急性肺損傷を軽減することも報告されている。
そこで、HMVEC-Lにフルバスタチンを作用させたところ、CLDN5の遺伝子発現量を増加できることを確認した。また、SARS-CoV-2の血管チャネルへの侵入およびVE-cadherinを介した細胞間接着の減弱を部分的に防止したという。以上の結果から、フルバスタチンはCLDN5の発現を増加させ、SARS-CoV-2による血管内皮バリア破壊を抑止することが示唆された。
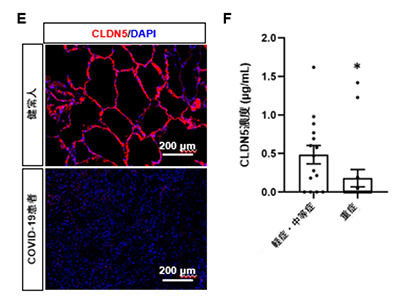
COVID-19患者の肺でCLDN5発現低下を確認
最後に、COVID-19とCLDN5の関係を調べるため、健常人およびCOVID-19患者の肺の検体を用いて、CLDN5の発現を解析した。その結果、COVID-19患者の肺においてCLDN5の遺伝子発現量が低下していた。また、CLDN5タンパク質がほとんど消失していた。
さらに、重症度の異なるCOVID-19患者の血清中のCLDN5濃度を測定したところ、重症患者の血清CLDN5濃度(180pg/mL)は、軽症・中等症患者の血清CLDN5濃度(484pg/mL)よりも低いことが判明した。CLDN5の主な供給源は血管内皮細胞であるため、血清中のCLDN5の量は、血管内皮細胞におけるCLDN5の発現量と相関していると考えられた。以上のことから、CLDN5の発現低下は、感染した気道チップだけでなく、COVID-19患者の肺においても確認された。
COVID-19を含む重症呼吸器感染症の病態解明と新規治療薬開発に期待
今回の研究成果により、気道チップを用いて、SARS-CoV-2感染が血管内皮細胞におけるCLDN5の発現を抑制することで、血管内皮バリア破壊を誘発することが発見された。また、同現象はCOVID-19患者の肺でも確認された。さらに、CLDN5の過剰発現とフルバスタチンの作用により、SARS-CoV-2によるバリア破綻を抑制できることも明らかにされた。
「今回の研究を通して、呼吸器におけるSARS-CoV-2による血管内皮バリア破壊のメカニズムを発見し、COVID-19に対する新しい治療戦略を提案した」と、研究グループは述べている。
▼関連リンク
・京都大学iPS細胞研究所 ニュース



