大腸がんの「がん幹細胞」はどう転移と関わっているのか
愛知県がんセンターは9月7日、大腸がんの転移能と幹細胞性を制御するメカニズムを明らかにしたと発表した。この研究は、同センターがん病態生理学分野の青木正博分野長、藤下晃章主任研究員らと、同システム解析学分野の山口類分野長、消化器外科部の清水泰博部長、遺伝子病理診断部の細田和貴部長、京都大学医学部附属病院・先端医療研究開発機構・大腸がん新個別化治療プロジェクトの武藤誠プロジェクトリーダーらによるもの。研究成果は、「Cancer Research」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
大腸がんは日本において罹患数第一位のがんとなったが、内視鏡技術の進歩による早期発見、手術療法や薬物療法等の発展により、肝臓や肺などに転移していない大腸がん患者の5年生存率は80%を超えている。一方で、肝臓や肺など他臓器への転移を伴う大腸がん患者の5年生存率は20%程度と極端に低下する。大腸がんが他臓器に転移するようになると、手術で取りきれなかったがんが拡大して再発する可能性が増え、また薬物療法に対しても抵抗性を示しやすくなり、治療が困難になる。そのため、転移のメカニズムを解明して治療標的を見つけ出すことは、大腸がん研究において喫緊の課題の一つになっている。
一方、近年の研究から、がんの組織には「がん幹細胞」と呼ばれる特殊ながん細胞が存在すること、「がん幹細胞」が再発や転移、治療抵抗性に重要な役割を果たすことがわかってきた。しかし、大腸がんの「がん幹細胞」がどのようなメカニズムで維持され、転移に関与するのかはほとんど明らかになっていない。
大腸がんが発生して肝転移に至る過程を再現するマウスモデルを開発
がん研究において、遺伝子改変によりがんを発症するマウスモデルが重要な役割を果たしてきたが、大腸がんの転移に関する研究のほとんどは、体外で培養した大腸がん細胞株やオルガノイドをマウスに移植するモデルを利用して行われてきた。大腸がんを自然発症する遺伝子改変マウスは、多くの腫瘍を発症するため転移を生じるまで生き延びないものがほとんどだった。これまでに大腸がんを発症して転移すると報告された遺伝子改変マウスは、活性型がん遺伝子を過剰に発現させたものや、薬剤を使って人為的に激しい大腸炎を引き起こさせたものなど、人間の体では起こりえない特殊な操作を行ったマウスに限られていた。
研究グループは今回、大腸がん患者で見つかる4つの遺伝子変異(Ctnnb1/Kras/Tp53/Smad4)を、非常に低い頻度で腸上皮細胞に導入することによって、100%の個体が悪性度の高い腺がんを発症して約20%の個体が肝転移を生じる、転移性大腸がんのマウスモデル(CKPSマウス)を作出することに成功した。このCKPSマウスは、大腸がんの発生から肝転移までの行程を再現するため、局所浸潤から他臓器への転移に至る過程や分子メカニズムを理解する上で重要な疾患モデルになると期待される。
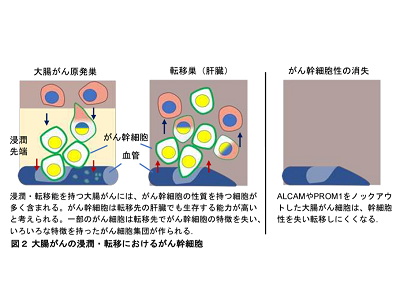
がん幹細胞の性質を獲得することで大腸がんの転移が促進
次に、大腸がんが転移するメカニズムを解明する目的で、質量分析装置を用いたプロテオーム解析を実施した。その結果、CKPSマウスの転移性大腸がんでは、非転移性大腸がんと比較して、ALCAM(CD166)やPROM1(CD133)と呼ばれるがん幹細胞マーカータンパク質の発現が増加しているこがわかった。また、CKPSマウス由来の大腸がん細胞株(CKPS細胞)は、高いスフェロイド形成能と転移能を示したが、これらのALCAMやPROM1をノックアウトすると、スフェロイド形成能および転移能が強く抑制された。このことから、がん幹細胞が転移に重要であること、そしてALCAM、PROM1は単なるマーカータンパク質ではなく、大腸がんの幹細胞性と転移に機能的に必要であることがわかった。
TGF-β/SMAD4経路とcAMP/PKA/CREB経路が大腸がんの幹細胞性を制御
さらに、大腸がんの幹細胞性の維持に2つのシグナル経路が関与することを発見した。1つはTGF-βからSMAD4につながる経路。このシグナル経路が活性化すると幹細胞性が抑制される(幹細胞性を負に制御)ことがわかった。大腸がん患者ではしばしばこのTGF-β/SMAD4経路を不活化する遺伝子変異が見つかることから、変異のないがん細胞より幹細胞性を維持しやすい(=転移しやすい)可能性が考えられる。
もう1つは、cAMP(cyclicAMP、サイクリックAMP)からPKA(proteinkinaseA、Aキナーゼ)、そして転写因子CREBにつながるシグナル経路で、このcAMP/PKA/CREB経路が活性化すると幹細胞性が亢進することが判明した(幹細胞性を正に制御)。cAMP/PKA/CREB経路の構成分子のノックアウト、あるいはシグナルを阻害する薬剤の投与によって、CKPS細胞のスフェロイド形成能や転移能が抑制されたことから、この経路が転移性大腸がんの治療標的となる可能性が示された。
発見された分子・シグナル経路は新たな治療標的となる可能性
今回の研究で、自然発症して肝転移を生ずる転移性大腸がんの新しいマウスモデルを確立し、大腸がんの幹細胞性を制御することで転移にも重要な役割を果たす分子・シグナル経路を同定した。「今回見つかった分子・シグナル経路を治療標的とすることで、大腸がんの転移・再発・治療抵抗性に関与する幹細胞性を制御する、新しい治療戦略の開発につながる可能性が期待される」と、研究グループは述べている。
▼関連リンク
・愛知県がんセンター プレスリリース



