少数のB細胞に潜伏感染し維持されるEBウイルス、2種類のT細胞が免疫監視を担う
広島大学は9月1日、EBウイルスに感染した細胞の抑え込みに重要なT細胞について解析を進め、マウスおよびヒトの細胞を用いた培養実験で、EBウイルス感染細胞を認識して活性化したヘルパーT細胞が本来とは機能的に異なるキラーT細胞へと機能転換することを確認したと発表した。この研究は、同大大学院医系科学研究科免疫学、同研究科小児科学、マックスデルブリュック分子医学センター(ドイツ)、シャリテベルリン医科大学(ドイツ)らの研究グループによるもの。研究成果は、「Cancers」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
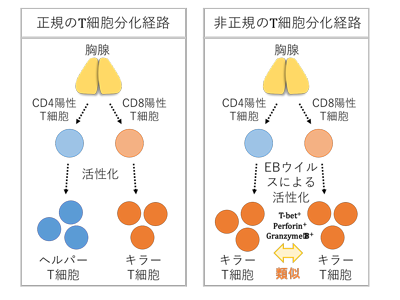
EBウイルスは成人の9割程度が感染歴を有し、人に潜伏感染するがんウイルスである。幼小児での感染はほとんどが無症状であるが、成人期での初感染は比較的重度な伝染性単核球症をひき起こす。感染から回復後もEBウイルスはごく少数のB細胞に潜伏感染し生涯にわたり維持される。通常は免疫細胞による監視下におかれ感染細胞の増殖が抑制されているが(免疫監視)、免疫抑制状態(臓器移植、HIV感染、加齢性免疫不全、先天性遺伝子異常など)に陥るとウイルスが再活性化し、慢性炎症や腫瘍を引き起こし致命的になる場合がある。近年では初感染の高年齢化や各種自己免疫疾患との関連が指摘されている。EBウイルス感染キャリアは社会全体におよび、また関係する疾患が多岐にわたることから社会的影響が大きい。免疫監視を中心的に担っているのは主に2種類のT細胞で、ヘルパーT細胞とよばれるCD4陽性T細胞とキラーT細胞とよばれるCD8陽性T細胞である。それぞれ司令塔として免疫反応を補助する役割と、武装化してウイルスなどに感染した細胞を殺して排除する役割に機能が区別されているとされてきた。
EBウイルスに感染した多くの人において、特異的な免疫を獲得し、それによってほぼ生涯にわたってウイルス感染細胞を抑え込んでいる。これまでヘルパーT細胞とよばれるCD4陽性T細胞群の中に、細胞傷害活性をもったT細胞が存在することが示唆されていたが、EBウイルス感染細胞に対して特異的に誘導されるそれら細胞の実態や分子レベルでの特徴はよくわかっていなかった。
ヘルパーT細胞にも高い細胞傷害活性を確認、T細胞分化の方向づけはウイルス感染などの環境要因によっても可塑的に決定
今回、EBウイルス感染を模倣したマウス細胞に対してCD4陽性T細胞とCD8陽性T細胞それぞれから特異的エフェクターT細胞を分化誘導し、それらの表現型や細胞傷害活性について比較検討を行った。その結果、どちらの細胞種からもエフェクターメモリー様表現型を示すT細胞が誘導され、いずれも極めて高い細胞傷害活性を有していることが確認された。同様の結果が、ヒトの末梢血T細胞とEBウイルス感染B細胞を用いた実験からも確認された。今回見出された細胞傷害性CD4陽性T細胞は、一般的なキラーT細胞と同じくグランザイムやパーフォリンといった細胞傷害分子を高発現しており、再刺激直後には脱顆粒マーカーであるCD107aを上昇するなど、パーフォリン-グランザイム経路により細胞傷害機能を発揮している可能性が強く示唆された。興味深いことに、これら2つのT細胞群は細胞傷害活性に関連する遺伝子群だけでなく、遺伝子の全体に渡って非常に似通った発現パターンを示していることが初めて明らかとなった。また遺伝子発現を制御する転写因子であるT-betの発現が、タンパク質レベルでグランザイムBやパーフォリンと良く相関することもわかった。以上のことから、EBウイルス特異的な細胞傷害性CD4陽性T細胞の分化は、一般的なキラーT細胞であるCD8陽性T細胞と共通したメカニズムによって制御されている可能性が考えられた。このような分化の方向づけはT細胞の種類に必ずしも束縛されるものではなく、ウイルス感染などの環境要因によっても可塑的に決定され誘導されている可能性が示唆された。
EBウイルスが潜伏感染する細胞はがん化する能力を備えている。そのためがんに対する免疫監視のモデルとしても、これまでEBウイルス感染細胞に対する免疫監視機構について精力的に研究が進められてきた。「EBウイルス関連以外のがんにおいてもCD4陽性細胞傷害性T細胞が誘導されるのか、またそれらがどの程度がんの免疫監視に寄与しているのかなど今後明らかにしていく必要がある。加えてCD4陽性細胞傷害性T細胞を任意に誘導する技術の開発は、がん治療に新たな選択肢をもたらす可能性がある」と、研究グループは述べている。
▼関連リンク
・広島大学 研究成果




