提供可能な(幹)細胞治療は?日本の現状を把握し、問題点を明らかにするための調査を実施
京都大学iPS細胞研究所(CiRA)は9月2日、日本の再生医療法の下で、安全性や有効性が疑われる(幹)細胞治療が提供されている実態と、それが同法の構造的な課題に起因する可能性を報告したと発表した。この研究は、CiRA上廣倫理研究部門、京都大学高等研究院ヒト生物学高等研究拠点(WPI-ASHBi)の藤田みさお教授らの研究グループによるもの。研究成果は、「Cell Stem Cell」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
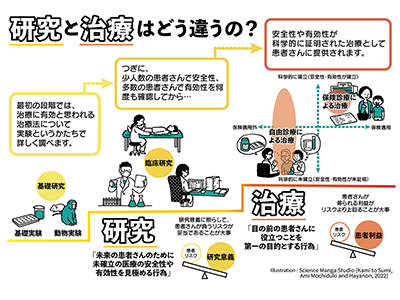
安全性や有効性が証明されていない(=科学的エビデンスがない)幹細胞治療が、高額で患者に提供され、世界中で問題視されている。合併症または死亡といった有害事象や、患者・家族による訴訟も報告されている。本来、治療は研究を通じて安全性や有効性が証明され、初めて患者に提供される。しかし、日本では自由診療という枠組みで医師と患者の合意があれば、安全性や有効性の証明が十分でない治療でも提供が可能であり、その実態も十分に把握されていない。2014年に制定された日本の「再生医療等安全性確保法(再生医療法)」は、自由診療でも細胞を治療として人に投与する場合は、専門委員会による提供計画の承認や、厚生労働省への提出など、一定の条件を設けている。しかし、中には安全性や有効性が定かではない治療が含まれている可能性がある。
2017年に、再生医療法の一部が改正され、「再生医療等を受ける者に対する説明文書及び同意文書」を厚生労働省のウェブサイトに開示することが義務づけられた。そこで、同研究では、この文書を元に、再生医療法下で現在、どのような(幹)細胞治療の提供が可能となっているのか、日本の現状を正確に把握し、問題点を明らかにすることを目指した。
ISSCRのGLが非難する治療、科学的エビデンス未確立のがん免疫療法が多数含まれていた
文書を分析した結果、2,377医療機関による3,467件の(幹)細胞治療の提供が可能となっていた。その中には、培養した(幹)細胞を患者に投与する治療といったISSCR(国際幹細胞学会)のガイドラインが非難する治療のほか、科学的エビデンスが確立していないがん免疫療法が多数含まれていたという。
今後の再生医療法改正、3つの基本的概念を明確に
こうした状況は、再生医療法の構造的な課題に起因する可能性が考えられる。すなわち、再生医療法では、研究開発から治療の実用化に至るプロセスにおいて重要な3つの基本的概念((1)研究で安全性と有効性が証明された医療が治療になること、(2)研究と治療の定義とその区別、(3)「新規性の高い未確立医療技術」と「未検証の治療」の区別)を明確にしていない。そのため、研究による科学的検証を経ない治療が、患者に多数提供されるという事態につながっているのではないか、と研究グループは論じた。
今後の再生医療法の改正においては、こうした3つの基本的概念を明確にし、医療機関、医師および特定/認定再生医療等委員会といった関係者の間で確実に共有できる内容または運用を実現することが望まれる。
研究と治療の区別が曖昧で誤解されやすい医療と法規制の課題、さらに検討を
今回の研究の意義は、安全性や有効性が疑わしい(幹)細胞治療を法律で禁じていない、非英語圏の日本における実態を報告した点にある。これまでに海外で行われた実態調査は、ほとんどがそうした治療を法律で禁じている国や、英語圏からの報告だったためだ。
同研究の成果が周知されることによって、海外で問題視されている(幹)細胞治療が日本でも課題として広く認知されること、研究によって安全で有効と科学的に証明されて初めて治療として提供されるという基本的な考え方が浸透すること、合法だから安全で有効と誤解したまま治療を受ける患者が減ることが望まれる。また、専門分野ごとに再生医療の科学的エビデンスが整理されることも期待される。
研究グループは今後、一般市民を対象としたアンケート調査を通して、再生医療に対する認識や誤解について明らかにすること、また、研究と治療の区別が曖昧で誤解されやすい医療と法規制の課題についてさらに検討を進めたいとしている。
▼関連リンク
・京都大学iPS細胞研究所(CiRA) プレスリリース




