さまざまな臓器が侵される難治性自己免疫疾患、詳細な病態は未解明
理化学研究所(理研)は8月23日、全身性エリテマトーデス(SLE)の病態に関わる免疫細胞の遺伝子発現異常を多数同定したと発表した。この研究は、理研生命医科学研究センター自己免疫疾患研究チームの中野正博特別研究員、ヒト免疫遺伝研究チームの石垣和慶チームリーダー、自己免疫疾患研究チームの山本一彦チームリーダー、東京大学大学院医学系研究科アレルギー・リウマチ学の藤尾圭志教授らの研究グループによるもの。研究成果は、「Cell」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
全身性エリテマトーデス(SLE)は、免疫システムが自己の細胞や臓器を攻撃する自己免疫疾患の一つで、ひとたび発症すると寛解と増悪を繰り返し、治癒することが困難な慢性疾患である。しかし、(1)多くの遺伝子が疾患の病態に関与すること、(2)血液中の多様な免疫細胞が複雑に病態成立に関与すること、(3)疾患活動性や臓器症状(皮膚・関節・腎障害など)が患者ごとに大きく異なることなどの理由から疾患の病態理解が進まず、効果的な治療薬があまり多く開発されていない。
免疫細胞集団を細かく分類し、症状を特徴付ける遺伝子発現パターンを調査
SLEの病態を理解するには、患者に起きている免疫状態の異常を調べる必要がある。免疫細胞の遺伝子発現情報は、個人の免疫状態をリアルタイムに評価する有用な指標であるが、過去の遺伝子解析研究では、一度の研究で調べるSLE患者の数が少なかったため、異なる臨床症状の患者にどのような遺伝子発現の違いがあるかを十分に解明できなかった。また、血液のあらゆる免疫細胞集団をひとまとめにして解析していたため、SLE患者のどの免疫細胞でどのような遺伝子発現異常が起きているか詳しくわかっていなかった。
研究グループは、さまざまな症状のSLE患者の血液から細胞集団を細かく分けて、それぞれの症状を特徴付ける遺伝子発現パターンを調べることで、SLEの複雑な病態メカニズムを詳細に解明することを目指した。
疾患の「発症」あるいは「増悪」に関わる遺伝子群、病態メカニズムの違いを示唆
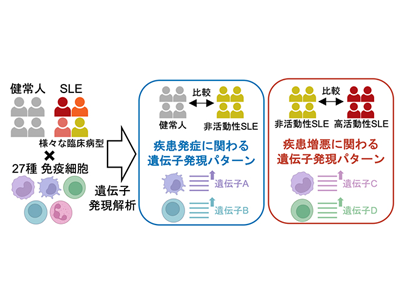
まず、機能ゲノムコホートImmuNexUTにおけるSLE患者136例と健常人89例から27種に及ぶ免疫細胞6,386サンプルをセルソーターで分取し、RNAシーケンスで遺伝子発現量を網羅的に調べる過去最大規模の解析を行った。今回あらゆる疾患活動性の患者が参加したことで、大きく二つのタイプの遺伝子発現パターンが定義された。一つは寛解状態にある非活動性のSLE患者群と健常人を比較した発現変動遺伝子からなる「疾患状態シグネチャー」と呼ばれるタイプであり、疾患の発症に関わる遺伝子群を反映。もう一つは高疾患活動性と非活動性のSLE患者群を比較した発現変動遺伝子からなる「疾患活動性シグネチャー」と呼ばれるタイプであり、疾患の増悪に関わる遺伝子群を反映していた。27の細胞種それぞれで解析を行い、疾患状態シグネチャー、疾患活動性シグネチャーともに1細胞種当たりおよそ2,000もの発現変動遺伝子を同定した。
細胞種ごとに疾患状態シグネチャーと疾患活動性シグネチャーを比較してみると、多くの細胞で両者の遺伝子のメンバーが大きく異なることがわかった。例えば、免疫シグナルの担い手であるサイトカインをコードする遺伝子に注目すると、疾患状態シグネチャーと疾患活動性シグネチャーではそれぞれ異なるサイトカイン群が同定された。これらの結果から、SLEの発症と増悪では異なる病態メカニズムが働いている可能性が高いことが初めて明らかになった。
27の細胞種ごとの疾患活動性シグネチャー、新たな治療標的探索にも
次に、SLEの臓器症状の多様性に注目し、それぞれの臓器症状でどの免疫細胞が活性化しているかを調べた。主成分分析と分散成分解析を免疫細胞種ごとの遺伝子発現データに応用することで、皮膚症状を持つ患者ではヘルパーT細胞の一種であるTh1細胞、関節症状を持つ患者では単球系細胞、腎症状を持つ患者では好中球系細胞の遺伝子発現パターンが最も強い関連を示し、それぞれの症状で異なる免疫細胞が活性化していることが示唆された。
さらに、既存のSLE治療薬が患者のどの免疫細胞に作用しているかを調べた。ベリムマブ治療前後の発現変動遺伝子はB細胞系細胞に集積し、ミコフェノール酸モフェチル内服者と非内服者の発現変動遺伝子はTh1細胞、メモリーCD8陽性T細胞、形質芽細胞に集積することが明らかになった。さらに、これらの治療薬で抑制された遺伝子群は疾患活動性シグネチャー遺伝子群と特に治療反応良好患者群でよく重複しており、現在のSLE治療薬が疾患活動性シグネチャーを抑制することで、臨床的な効能を発揮していることが確認できた。以上のことから、今回同定された27の細胞種ごとの疾患活動性シグネチャーは、新たなSLEの治療標的を探索する上でも有用である可能性が示された。
過去の大規模GWASとの統合解析、ゲノムリスク多型は「憎悪」遺伝子群をあまり捕捉できていない
最後に、過去の大規模SLEゲノムワイド関連解析(GWAS)結果との統合解析を実施した。これまでのGWAS研究でSLEの発症リスクを高めるゲノム上の遺伝子多型(リスク多型)が100以上同定されたが、これらの多くがどのよう機序を経てSLEの病態に関わっているか、十分にわかっていなかった。統合解析において層別化LDスコア回帰法を用いることで、ゲノム上のSLEのリスク多型が疾患状態シグネチャー遺伝子群をコードする領域の周囲に多く存在する一方、疾患活動性シグネチャー遺伝子群の周囲にはあまり多く存在していないことがわかった。
この結果は、GWAS研究が主として「疾患対健常人」の症例対照研究に基づいて行われてきたことを考えると理に適った結果である。同時に、GWAS研究で得られた結果が疾患の増悪に関わる遺伝子群を十分に捕捉できていないことも示された。つまり、今後のGWAS研究は従来の症例対照研究から症例内の多様性に注目した研究デザインにシフトする必要があると考えられたという。
疾患活動性シグネチャー情報を基点にした、新たな治療標的の開発に期待
SLEの治療目標は、疾患活動性をなるべく抑制することで再燃やダメージの蓄積を予防することと定められている。つまり、今回同定した疾患活動性シグネチャーに含まれる遺伝子情報を基点に、病態メカニズムに即した形で新たな治療標的が開発されることが期待できるという。「今後同一患者の遺伝子発現状態の推移を追う縦断的研究を行うことで、SLEの予後や再燃を予測する目安となるバイオマーカーの同定につながる可能性が期待できる」と、研究グループは述べている。
▼関連リンク
・理化学研究所 プレスリリース



