アルテプラーゼ改変で作られたテネクテプラーゼ、国内開発目途が立たない状況が続いた
国立循環器病研究センターは8月19日、急性期脳梗塞の新たな血栓溶解薬開発のために実施中のT-FLAVOR試験について、安全性確認相の実施結果に基づいて、厚生労働省の先進医療技術審査部会から試験の本相(比較検討相)へ進むことが承認されたと発表した。この研究は、同研究センターの豊田一則副院長と杏林大学(東京都三鷹市)医学部脳卒中医学教室の平野照之教授を共同研究開発代表者とする、国内多施設共同の研究グループによるもの。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
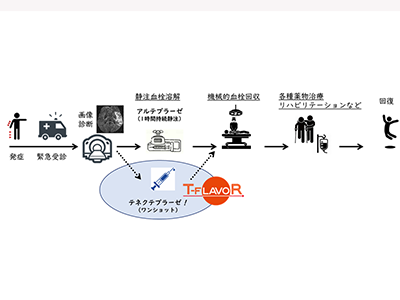
急性期脳梗塞患者への静注血栓溶解療法は、世界中に普及した標準治療だ。血栓溶解薬として遺伝子組換え組織プラスミノゲンアクチベータ(tPA)のアルテプラーゼが使われるが、日本は血栓溶解薬開発の国際競争で後れを取り、アルテプラーゼの承認(2005年)が米国より9年遅れた。この10年来アルテプラーゼを改変して作られた「テネクテプラーゼ」(急性心筋梗塞治療薬)の脳梗塞治療効果が海外の複数の臨床試験で示され、近年では使用を推奨する治療ガイドラインも海外で散見される。しかし、日本ではテネクテプラーゼを取り扱う製薬企業がなく、日本脳卒中学会などからの働きかけにも関わらず、国内開発の目途が立たない状況が続いた。
脳主幹動脈の閉塞を伴う脳梗塞患者220例を対象にT-FLAVOR試験を実施
この状況を打破し、海外とのドラッグラグを防ぐために、日本医療研究開発機構(AMED)からの研究助成を受けて始まったのが、医師主導臨床試験T-FLAVOR(Tenecteplase versus alteplase For LArge Vessel Occlusion Recanalization)試験だ。同試験の概要は臨床研究実施計画・研究概要公開システムに公開され(jRCTs051210055)、またプロトコール論文も公表されている。中央事務局、中央薬局、データセンターなどを国循が務め、国内14施設が患者登録に参加する。
本相(比較検討相)では、発症4.5時間以内に血栓溶解薬を投与開始可能で、さらにカテーテルでの機械的血栓回収療法まで行うことが適切と判断された、脳主幹動脈の閉塞を伴う脳梗塞患者220例を対象とする。血栓溶解薬としてテネクテプラーゼを用いる群と、アルテプラーゼを用いる群とに1:1に無作為に割り付ける。主要評価項目は、閉塞脳動脈の早期有効再開通率。他に、90日後の患者自立度や死亡率、早期の症候性頭蓋内出血など、多くの項目を評価する。
国循8月/他施設9月から、患者登録開始へ
テネクテプラーゼは国内未承認のため、本相に進む前に安全性を確認する先行相を設け、主管施設である国循のみで患者登録を進めた。先進医療技術審査部会の承認を得て、国循では8月から、他の施設では9月から、患者登録を始める目途が立ったという。
先進医療は、国民の安全性を確保し、患者負担の増大を防止するといった観点を踏まえつつ、国民の選択肢を広げ、利便性を向上するという観点から、未だ保険診療の対象に至らない先進的な医療技術や未承認の医薬品、医療機器の使用などについて、安全性、有効性等を確保するために一定の施設基準を設定し、当該施設基準に該当する保険医療機関の届出により、または安全性、有効性等を確保するために対象となる医療技術ごとに実施医療機関の要件を設定し当該要件に適合する保険医療機関の承認により、保険診療との併用を認めるものだ。
同試験を完遂した後も、厚生労働省などに対し、国内でのテネクテプラーゼの承認に向けた取り組みを続ける必要がある。研究グループは、日本脳卒中学会などの協力を得て、適切な急性期脳梗塞を確立させるためのステップを着実に進めて行くとしている。
▼関連リンク
・国立循環器病研究センター プレスリリース




