ヒトの大腸上皮幹細胞の生体内での動態は不明だった
慶應義塾大学は8月12日、ヒト大腸の増殖を司る幹細胞は、マウスと比較して多くが休止期状態にあることを発見し、炎症からの再生における重要性を初めて解明したと発表した。この研究は、同大大学医学部坂口光洋記念講座(オルガノイド医学)の佐藤俊朗教授、同内科学教室(消化器)の石渡景子特任助教、杉本真也助教、金井隆典教授らの研究グループによるもの。研究成果は、「Gastroenterology」オンライン版に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
細胞は、分裂するたびに複製の遺伝子変異が起こるリスクが生まれる。そのため、体が大きく寿命が長いヒトは、体が小さく寿命が短いマウスよりも多くの細胞分裂を繰り返し、遺伝子変異が蓄積することでがんになりやすいのではないかと思われるが、実際はそうではない。ヒトが長寿命にも関わらずがんになりにくいのは、ヒトの細胞の増殖速度が遅いことが原因と考えられる。一般的に血液や筋肉など各組織に存在する幹細胞は、ほとんど分裂増殖しない、休止期にある寿命が長い細胞と考えられており、実際に抗がん剤が効きづらく、放射線療法に耐性がある。
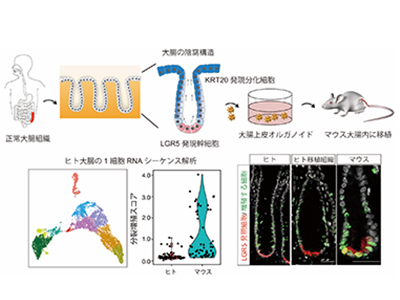
一方で、腸管組織は3~5日ごとに活発にターンオーバーを繰り返すダイナミックな臓器であり、腸管上皮の増殖を司っているのは腸管上皮幹細胞だ。腸管上皮幹細胞はLGR5遺伝子を高く発現しており、活発に増殖をしながらも寿命が長く、自身の複製と、大腸のさまざまな細胞に分化できる能力を持つ。マウスのLgr5発現幹細胞は活発に増殖しているがゆえに、上皮が損傷すると死滅しやすく、上皮の再生過程では、普段は分化した細胞が幹細胞に戻る(脱分化)ことで再生に重要な役割を果たす。しかし、ヒトの腸管上皮幹細胞が定常時および炎症からの再生時にどのような動きを見せるのかは、生体内で観察する手段がなく不明だった。
遺伝子編集ヒト大腸上皮オルガノイドをマウス大腸に肛門から移植、生きたまま観察
研究グループは先行研究で、体外でヒトの大腸上皮細胞を無限に増殖させるオルガノイド技術を開発。さらにこの技術を応用し、マウスの大腸上皮を剥離した後に、遺伝子編集したヒトの大腸上皮オルガノイドをマウスの大腸に肛門から移植する技術を開発し、ヒト大腸上皮細胞の働きをマウスの腸管内で生きたまま観察することに成功した。今回の研究では、これらの技術を用いて、ヒト大腸上皮幹細胞が生体内で定常時および炎症からの再生時にどのような役割を果たすのかを検証した。
ヒト大腸には休止期幹細胞が多く、TGF-βシグナルが休止期を制御
研究グループは、ヒト大腸とマウス大腸の1細胞RNAシーケンス法を行い、それぞれの幹細胞の細胞周期を比較。ヒトでは休止期にある幹細胞が多く、マウスでは細胞分裂増殖期にいる幹細胞が多いことを実証した。組織解析においても同様の結果だったという。さらに、ヒトの休止期にある幹細胞をp27というマーカーで可視化し、マウスの生体内でヒト大腸幹細胞の動きを観察することに成功した。
次に、マウスとヒトの幹細胞の増殖速度の差を決定する因子として、TGF-βシグナルに着目。マウスもヒトも上皮の周りの間質組織からの刺激によりTGF-βシグナルが活性化されているが、ヒト幹細胞はTGF-βシグナルへの感受性が高いため、休止期幹細胞が多いことが示唆された。そこでTGF-βシグナルが休止期に関与しているかを調べるため、ゲノム編集技術を使用して大腸上皮オルガノイドのTGFBR2遺伝子をノックアウトした。すると、予想通り、TGF-βシグナルが活性化されなくなった大腸上皮幹細胞は増殖が速くなった。この結果から、休止期のLGR5幹細胞はTGF-βシグナルによって制御されるというメカニズムを証明された。
休止期幹細胞は普段はゆっくり増殖し上皮損傷に耐え、再生時に増殖が加速
休止期にあるLGR5発現細胞が幹細胞であるかを調べるため、細胞系譜解析により休止期幹細胞の子孫細胞を蛍光タンパク質で可視化し、追跡した。この解析により、1つの休止期LGR5発現幹細胞が自分自身を産生するとともに、分化した子孫細胞を増やしながらゆっくり増殖する様子を捉えることに成功。さらに、抗がん剤で上皮に損傷を加えても抵抗性があり死滅せず、かつ、損傷からの再生過程でクローン増殖が速くなることを見出した。
これまで、マウスのLgr5発現幹細胞は上皮の損傷で簡単に死滅することが知られていたが、ヒトでは反対の現象が確認されたことから、休止期幹細胞は上皮再生の過程においてより重要であることが明らかになった。
ヒトLGR5発現幹細胞は休止期ゆえに上皮の損傷に抵抗性、再生時にも生き延び機能
さらに研究グループは、大腸幹細胞を特異的に殺傷すると、大腸上皮がどのように再生するのかを検証した。ゲノム編集技術によりLGR5発現細胞だけを選択的に殺傷するモデルを用いて、マウスの生体内でヒト大腸上皮の再生を観察。その結果、LGR5発現細胞を殺しても、5日後にはLGR5発現細胞が再度出現しており、上皮の再生は問題なく行われていることが判明した。このことから、上皮の再生にはLGR5発現細胞以外の関与があると考えられた。そこで、分化した細胞をKRT20で標識し、KRT20発現細胞が上皮の再生時にどのように関わるのかを検証した。すると、普段は分化した細胞は増殖せず消失してしまったが、LGR5発現幹細胞を殺した時だけ、KRT20発現細胞がLGR5発現細胞に「先祖返り(脱分化)」して増殖することがわかった。
最後に、抗がん剤で上皮を損傷させた後に分化した細胞が先祖返りするのかを検証。その結果、上皮を損傷させても分化した細胞は先祖返りしにくいことがわかった。これは、マウスとは正反対の現象であり、ヒトLGR5発現幹細胞が休眠しているがゆえに上皮の損傷にも抵抗性があり、損傷からの再生時にも生き延びて、幹細胞の席に居座るからと考えられた。これらの結果をふまえ、炎症からの再生には休止期のLGR5発現幹細胞が重要であると結論付けられた。
炎症性腸疾患や大腸がんの新規治療法開発に期待
今回の研究成果により、オルガノイド、ゲノム編集技術、移植技術を組み合わせて、ヒトの大腸上皮幹細胞の動きをマウスの生体内で観察することにより、休止期幹細胞の定常時や炎症からの再生過程における役割が初めて解明された。これにより、ヒトはマウスより体が大きく長寿命であるにも関わらずランダムな突然変異が起こりにくく、がんになりにくいことが明らかになった。ヒトの細胞周期が遅いことは、生物の進化の過程で理にかなった変化であると言える。
「今後、炎症からの再生過程で必要な正常幹細胞機能の解明だけでなく、炎症性腸疾患や大腸がんの根治を目指す上で新たな治療開発の足掛かりとなることが期待される」と、研究グループは述べている。
▼関連リンク
・慶應義塾大学 プレスリリース




