「L-アラビノース」と「スクロース」が腸内環境に及ぼす協調作用は?
慶應義塾大学は7月20日、腸内細菌によって利用される2つの異なる糖が特定の腸内細菌に協調的に作用することにより、高脂肪食誘導性の肥満を抑制することを発見したと発表した。この研究は、同大大学院薬学研究科修士課程の冨岡佐和子氏(研究当時)、同大薬学部の関夏実特任助教(研究当時)、金倫基教授らの研究グループによるもの。研究成果は、「Cell Reports」電子版に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
食物繊維はヒトの酵素で消化・吸収できない難消化性の糖類だが、一部の腸内細菌によって利用されることが知られている。これら難消化性・難吸収性の糖は近年、「腸内細菌利用糖(MACs)」と呼ばれている。MACsは特定の腸内細菌の主要なエネルギー源であり、これらを発酵・分解する際に、短鎖脂肪酸などの宿主に有益な代謝物を産生する。MACsには難消化性多糖・オリゴ糖、難吸収性糖など多様なものがあるが、これらを栄養源として利用できるかは各腸内細菌によって異なる。そのため、MACsが腸内細菌叢および宿主の生理機能に与える影響は各MACによって異なると言える。
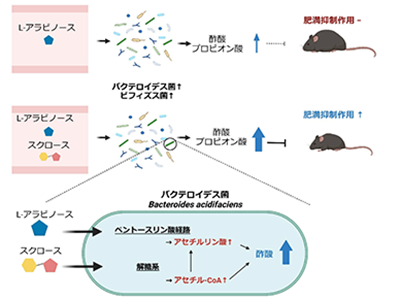
穀物の繊維質に多く含まれる低カロリーの単糖である「L-アラビノース」は、天然甘味料および食品添加物として使用されている。L-アラビノースは小腸で吸収されにくく、また、腸のスクラーゼ活性を阻害することによってスクロースの吸収も減少させる。そのため研究グループは、L-アラビノースとスクロースを同時に摂取することにより、両者はMACsとして機能し、腸内環境改善に相乗的な効果を発揮する可能性があると考えた。しかし、L-アラビノースとスクロースが協力して腸内細菌叢に作用し、宿主機能を促進するのか否か、また、両者が腸内細菌にどのように作用するかは不明だった。そこで今回、MACsであるL-アラビノースとスクロースの腸内環境に及ぼす協調作用について明らかにすることを目的として研究を行った。
L-アラビノースはスクロース存在下で「抗肥満作用」を発揮
まず、スクラーゼに対するL-アラビノースの阻害効果を検証した。L-アラビノースの存在下または非存在下で絶食マウスにスクロースを経口投与し、血糖値を比較したところ、アラビノース投与マウスで血糖値の上昇が抑えられた。次に、L-アラビノースの抗肥満効果を検証した。スクロースを含む高脂肪食を与えたマウスに、L-アラビノースを投与したところ、非投与マウスと比べて体重増加量や脂肪重量が小さいことが判明した。さらに、高脂肪食誘発性肥満に対するL-アラビノースの抑制効果が、食餌性スクロースの存在下で発揮されるか否かを評価した。小腸から吸収される際にスクラーゼによる影響を受けないグルコースを経口投与した場合、L-アラビノース投与マウスと非投与マウスで同等のレベルまで血糖値が上昇したことから、L-アラビノースはグルコースの吸収を阻害しないことが明らかになった。そこでスクロースを除去し、糖源をすべてグルコースにした高脂肪食をマウスに与えた。その結果、L-アラビノースによる抗肥満作用は見られなくなったという。
L-アラビノースの特性をさらに評価するために、スクラーゼ阻害活性を持たない光学異性体のD体のアラビノース(D-アラビノース)と、L-アラビノース同様にスクラーゼ活性を阻害するD-キシロースの抗肥満作用を検証した。その結果、スクロースを経口投与した後の血糖値の上昇は、D-アラビノースでは抑制されなかった。また、スクロースを含む高脂肪食を与えたマウスにD-アラビノースを投与しても肥満を抑制することはできなかった。一方、D-キシロースはスクロース経口投与後の血糖値の上昇を抑制した。しかし、スクロースを含む高脂肪食を与えたマウスにD-キシロースを投与しても肥満は抑制されなかった。以上のことから、L-アラビノースはスクロースの存在下で抗肥満作用を発揮すること、その効果は、スクラーゼ阻害以外の別の機能も持つ可能性が示唆された。
L-アラビノースはスクロースの非存在下でも腸内細菌叢の組成を変化させた
前述のように、L-アラビノースは難吸収性の糖であることから、MACとして機能している可能性が考えられた。そこで次に、L-アラビノースの抗肥満作用が腸内細菌叢に依存しているか否かを検証した。マウスの腸内細菌叢の組成を解析したところ、高脂肪食の摂食に加え、L-アラビノースの投与によっても腸内細菌叢の組成が変化することが明らかになった。また、L-アラビノースの投与によって、バクテロイデス属菌(Bacteroides)とビフィズス属菌(Bifidobacterium)の相対割合が増加。スクロースを含まない高脂肪食を与えたマウスにおいてもL-アラビノースの投与によってバクテロイデス属菌とビフィズス属菌の相対割合が増加することが判明した。つまり、L-アラビノースはスクロースの非存在下でも腸内細菌叢の組成を変化させた。
L-アラビノースとスクロースは特定の腸内細菌からの短鎖脂肪酸産生を促進して抗肥満作用を発揮
そこで、L-アラビノースによる抗肥満作用に腸内細菌が関わっているかを検証するため、バクテロイデス属菌とビフィズス属菌を含む腸内細菌を抗菌剤で除去した。その結果、抗菌剤投与マウスではL-アラビノースによる抗肥満作用は発揮されなかった。さらに、L-アラビノースによる抗肥満作用は無菌マウスにバクテロイデス属菌(Bacteroides acidifaciens)のみが定着しているマウスでは発揮されたが、大腸菌のみが定着しているマウスでは発揮されなかった。
食物繊維の摂取により有益な腸内細菌代謝物である短鎖脂肪酸が産生されることが知られていることから、短鎖脂肪酸の主な受容体であるGpr43およびGPR41の欠損マウスを用いて、L-アラビノースによる抗肥満作用を観察した。その結果、L-アラビノースによる肥満抑制作用はGpr43およびGPR41の欠損マウスでは発揮されなかった。以上のことから、L-アラビノースによる抗肥満作用には特定の腸内細菌が寄与し、その実効代謝物として短鎖脂肪酸が関与していることが示唆された。
続けて、L-アラビノース投与後の腸内の短鎖脂肪酸の濃度を測定。その結果、高脂肪食を与えたマウスにL-アラビノースを投与すると、腸内の短鎖脂肪酸である酢酸・プロピオン酸の濃度が上昇した。この結果は、L-アラビノース投与で相対割合の増加したバクテロイデス属菌が酢酸・プロピオン酸を、ビフィズス属菌が酢酸を産生すること、GPR43/GPR41が酢酸・プロピオン酸の受容体として知られていることと合致するという。また、L-アラビノース投与による腸内の酢酸・プロピオン酸濃度の上昇はスクロース存在下でさらに促進された。
さらに、L-アラビノースによる短鎖脂肪酸の産生増加は抗菌剤投与により起こらなくなること、また、D-キシロースの投与では腸内の酢酸・プロピオン酸濃度の上昇は見られないこともわかった。これまでの結果から、L-アラビノースとスクロースは特定の腸内細菌からの短鎖脂肪酸の産生を相乗的に促進させることにより抗肥満作用を発揮することが示唆された。
L-アラビノースとスクロースは、協調的・相乗的に酢酸産生菌の異なる代謝経路を活性化
最後に、これら2つの糖が短鎖脂肪酸の産生において腸内細菌のどの代謝経路を活性化しているのかを検証した。L-アラビノースの投与で相対割合が増加し、抗肥満作用にも関わっていたB. acidifaciens(バクテロイデス属菌)を糖添加なし、またはL-アラビノース、スクロース存在下で培養後、菌体内の代謝物を比較した。その結果、全ての培養群でB. acidifaciensの菌体内代謝物が異なることが判明。酢酸産生経路についてさらに細かく解析したところ、L-アラビノースとスクロースの添加により、それぞれペントースリン酸経路、解糖系に関連する代謝物の増加が観察された。以上の結果から、L-アラビノースとスクロースは、バクテロイデス属菌の異なる代謝経路を活性化することにより、協調的・相乗的な酢酸産生を誘導していることが示唆された。
個人に合った腸内環境を作り上げるプレシジョン・プレバイオティクスの実装化に期待
食物繊維やオリゴ糖など、腸内細菌によって消費されるMACsは宿主の生理機能を向上させることが数多く報告されている。ヒトの健康に有益な作用を持つMACsは「プレバイオティクス」とも呼ばれている。ヒトの腸内には数百種類の腸内細菌が生息しているが、腸内細菌ごとに利用できる糖が異なるため、各MACが腸内細菌叢および宿主生理機能に与える影響も異なると考えられる。したがって、各MACを個人の健康状態や疾患に応じた腸内環境を構築できる「腸内細菌叢モジュレーター(変動因子)」として利用できる可能性がある。しかし、各MACが腸内細菌の代謝にどのような影響を与え、宿主の生理機能を調節するかについては不明な点が多く残されている。
今回の研究では、L-アラビノースとスクロースがMACsとして協調的に作用することにより、肥満を抑制することや特定の腸内細菌に異なる代謝変化を引き起こすことが新たに明らかにされた。「今後も各MACの特性を一つずつ明らかにしていくことにより、個人に合った腸内環境を作り上げる、プレシジョン・プレバイオティクスの実装化が期待される」と、研究グループは述べている。
▼関連リンク
・慶應義塾大学 プレスリリース




