AQP2膜輸送、バゾプレシンにより活性化されたPKAによって制御される分子学的機序は?
東京医科歯科大学は7月22日、LRBAが尿濃縮と体内の水恒常性維持に必須のタンパク質であることを突き止めたと発表した。この研究は、同大大学院医歯学総合研究科腎臓内科学分野の内田信一教授、安藤史顕助教、原悠大学院生らの研究グループによるもの。研究成果は、「The proceedings of the national academy of sciences」オンライン版に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
脱水症や下痢症などの体内から水が失われる病態において、腎臓が尿量を適切に減らし体内の水恒常性を維持することは、生体活動を破綻させないために必要な防御機構だ。水が不足し血液が濃縮されると、脳から抗利尿ホルモンであるバゾプレシンが分泌され、腎臓集合管において尿から水が再吸収される。通常、水の通り道であるアクアポリン2水チャネル(AQP2)は細胞の中にあるが、バゾプレシンから刺激をうけると細胞膜へ移動するため、尿中の水がAQP2を介して細胞膜を通過できるようになり体内へ水が保持される。AQP2の膜輸送はバゾプレシンにより活性化されたプロテインキナーゼA(PKA)によって制御されるが、その詳細な分子学的機序は不明だった。
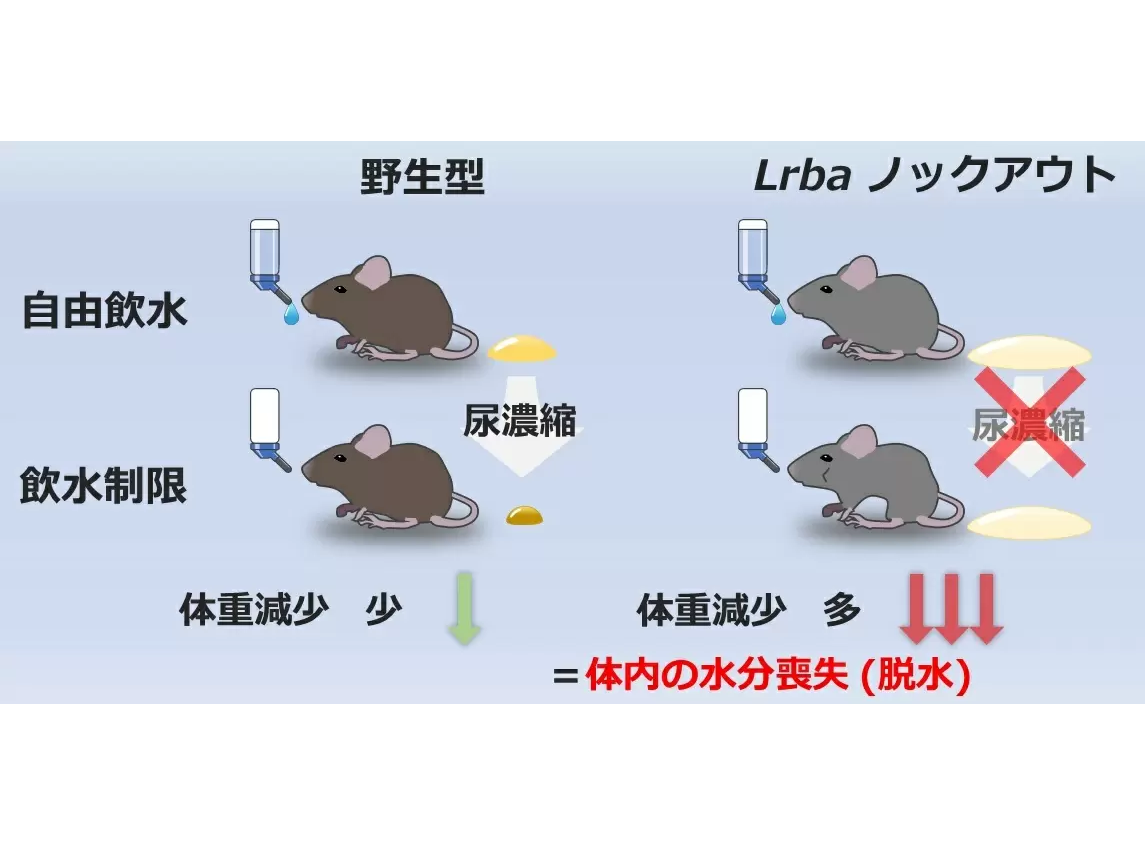
LRBAによりPKAがAQP2近傍に局在化、欠損マウスはAQP2活性化と水再吸収が高度に障害
研究グループは、新規AQP2制御分子を同定するために新しい実験手法を用いた。複数のPKA活性化作用を持つ化合物を腎臓集合管培養細胞に投与し、AQP2を含むPKAのシグナル分子をさまざまなレベルでリン酸化させ、AQP2と常に同じリン酸化動態をとるタンパク質としてLRBAを同定した。リン酸化動態の相関は、両者のタンパク質が近接していることを示唆しておりシグナル分子の解析において重要な意味を持つ。実際、マウスを用いた実験で、LRBAはAQP2と同一の細胞内小胞に局在していた。
LRBAはPKAの足場タンパク質(AKAP)としてPKAの細胞内局在を決める役割を持つことが知られている。LRBAをノックアウトすると足場の消失によりPKAがAQP2周囲に局在できなくなり、バゾプレシンを投与してもAQP2がリン酸化されなかった。その結果、Lrbaノックアウトマウスの飲水量を制限すると、尿濃縮機構の破綻により尿量を減らすことができず、体重が急激に低下した。
LRBA結合のPKA選択的活性化、多尿をきたす疾患の新規創薬標的の可能性
以前研究グループは、低分子化合物FMP-API-1/27がAKAPに結合するPKAの局在を変化させ、強力な尿濃縮作用を発揮することを同定した。AKAPはLRBA以外にも50種類以上報告されており、FMP-API-1/27は腎臓集合管において種々のAKAPの中でもLRBA-PKA結合へ特異的に作用していた。さらに、バゾプレシンもLRBA-PKA結合を標的にしていたことから、LRBAに結合するPKAを選択的に活性化することが、多尿をきたす疾患の新たな創薬標的になる可能性が示された。
今回の研究成果により、LRBAはバゾプレシンシグナルにおいてPKAによるAQP2のリン酸化を仲介する足場タンパク質としての役割を持つことがわかった。AKAPに結合するPKAは尿濃縮薬開発の標的分子として着目されてきたが、数々のAKAPの中で、LRBAに結合するPKAの局在変化が尿濃縮に最も重要であることを明らかにした、と研究グループは述べている。
▼関連リンク
・東京医科歯科大学 プレスリリース



