神経障害性や炎症性疼痛に有効なEPA、その分子メカニズムは?
岡山大学は7月19日、魚油や亜麻仁油などに含まれるオメガ3系多価不飽和脂肪酸(PUFA)のエイコサペンタエン酸(EPA)が小胞型ヌクレオチドトランスポーター(VNUT)を阻害することで、神経障害性や炎症性疼痛を予防・改善できることをモデル動物で見出したと発表した。この研究は、同大自然生命科学研究支援センターゲノム・プロテオーム解析部門、大学院医歯薬学総合研究科(薬学系)膜輸送分子生物学分野の宮地孝明研究教授、加藤百合特任助教(現:九州大学薬学研究院助教)、原田結加特任助教、東京農業大学応用生物科学部の岩槻健教授らの研究グループによるもの。研究成果は、「Proceedings of the National Academy of Sciences of the United States of America」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
慢性疼痛は軽微なものを含めると、世界人口の20~25%の罹患者がいるとされる。その医療費は世界で年間600億ドルにのぼり、毎年100億ドルずつ増加すると試算されている。このうち、がん、糖尿病、ウイルス感染などの神経障害が原因の神経障害性疼痛や、がん、痛風、リウマチなどによる炎症が原因の炎症性疼痛は耐え難い慢性疼痛だ。既存医薬品では鎮痛効果が十分であるとはいえず、モルヒネなどのオピオイド製剤や一般的な鎮痛薬のNSAIDsでは神経障害性疼痛に十分に奏効せず、また、神経障害性疼痛治療薬ではめまいや傾眠、意識消失などの副作用のために患者のQuality of Lifeを著しく低下させる課題がある。疼痛管理は臨床的に重大な課題だが、副作用の少ない、効果的な鎮痛薬はない。
EPAが神経障害性や炎症性疼痛に有効であることはこれまで報告されていたが、その分子メカニズムはよくわかっていなかった。また、研究グループでは、これまでにVNUTやその選択的阻害剤を同定し、VNUT阻害は神経障害性や炎症性疼痛、慢性炎症、インスリン抵抗性や高血糖を改善できることを明らかにしてきた。VNUTは、神経や内分泌、免疫細胞の分泌小胞に局在し、膜電位差を駆動力として塩化物イオン依存的にATPを小胞内に輸送する。分泌小胞が開口放出されると、ATPやその代謝物がプリン受容体に結合し、下流に情報を伝達する。この伝達様式をプリン作動性化学伝達といい、伝達異常によって慢性疼痛やうつ、代謝異常や慢性炎症などを引き起こす。
EPAの薬効は、研究グループが見出してきたVNUT阻害剤の薬効と極めて類似している。そのため、VNUTがこれまでの薬理効果の矛盾を説明できるEPAの分子標的であると仮説を立て、研究を行った。
極めて低濃度のEPAでVNUTのATP輸送活性をほとんど阻害
研究グループは、トランスポーターの独自の評価技術を用いて、EPAがVNUTのATP輸送活性を阻害するかを評価。ヒトVNUTタンパク質を精製し、人工膜小胞に組み込むことで、単一のヒトVNUTタンパク質を含む人工膜小胞を調製した。この小胞を塩化物イオン存在下で、膜電位差依存的なATP輸送活性を測定。その結果、極めて低濃度(半数阻害濃度IC50=67nM)のEPAでVNUTのATP輸送活性がほとんど阻害されることを見出した。
この他、構造が類似したオメガ3系PUFAやEPA代謝物の一部でもVNUTは阻害され、一方で、オメガ3系PUFAのもう一つの代表格であるドコサヘキサエン酸(DHA)、炎症性脂質メディエーターを産生するオメガ6系PUFAの代表格であるアラキドン酸ではVNUTを強く阻害しなかった。さらに、塩化物イオンはATPを小胞内に輸送するVNUTのアロステリック調節因子だが、EPAはこの塩化物イオンに対して競合的に阻害するアロステリック阻害剤であることを突き止めた。
EPAはプリン作動性化学伝達を遮断することで神経障害性疼痛を改善、マウスで確認
次に、神経障害性疼痛の発症に関与する神経細胞でATP放出の遮断効果を検証。その結果、低濃度のEPAは神経細胞からのATPの開口放出を完全に阻害することを明らかにした。その他の伝達物質の開口放出は阻害しなかったため、EPAはプリン作動性化学伝達を選択的に遮断できることが示された。
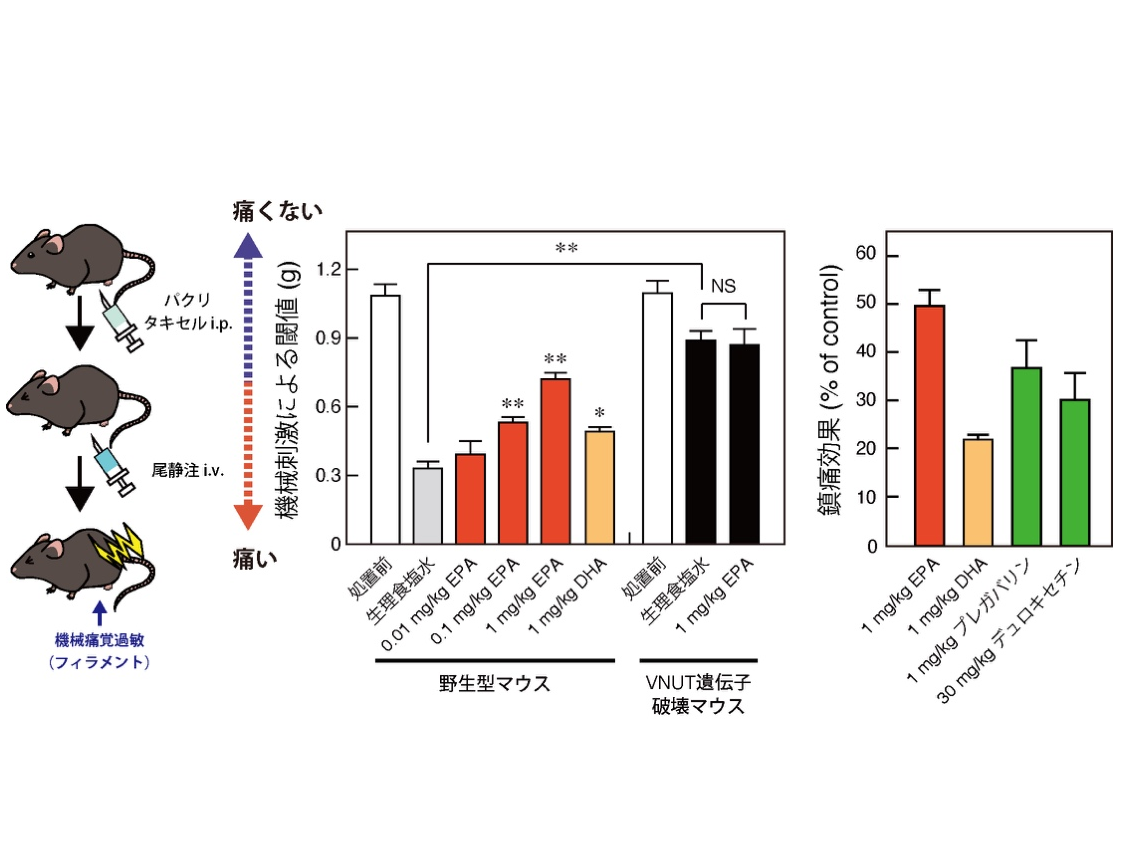
そこで、抗がん剤誘発性神経障害性疼痛モデルの野生型マウスとVNUT遺伝子破壊マウスでEPAの薬効を評価。化学療法治療を受ける患者の多くは、6か月以内に神経障害性疼痛などの副作用を生じることが知られており、副作用の軽減は化学療法治療の重要な課題の一つだ。VNUT遺伝子破壊マウスでは、野生型マウスに比べて、抗がん剤(パクリタキセル)により誘発される神経障害性疼痛が軽減し(治療効果)、さらにその発症が大幅に遅延すること(予防効果)を明らかにした。
神経障害性疼痛の代表的な既存医薬品(プレガバリンやデュロキセチン)は、めまいや傾眠、意識消失などの副作用が報告されている。野生型マウスにEPAを投与すると、既存医薬品よりも鎮痛効果が高いこと、また、既存医薬品における傾眠などの副作用がEPAでは観察されないことが明らかになった。
VNUT遺伝子破壊マウスではEPAの薬効が消失したことから、EPAはプリン作動性化学伝達を遮断することで、神経障害性疼痛を改善できることが明らかになった。EPAは神経障害性疼痛だけでなく、神経障害によって生じるインスリン抵抗性や、炎症性疼痛もVNUTを標的に改善できることがわかったとしている。
新規VNUT阻害剤、生活習慣病に対する新しいタイプのトランスポーター創薬につながると期待
今回の研究より、EPAやその代謝物は生理的なVNUT阻害剤であり、VNUT阻害により神経障害性疼痛や炎症性疼痛、インスリン抵抗性を予防・治療できることが動物実験で明らかになった。EPA製剤はすでに高脂血症や動脈硬化症の治療で臨床応用されており、また、健康食品としても広く利用されているため、すでにヒトに対する安全性は実証されている。VNUT遺伝子破壊マウスは野生型マウスと比べて、重篤な症状はこれまでに見つかっていない。さらに、これらの疾患に対して EPA+DHA製剤よりもEPA製剤の方が有効であるとも報告されている。DHAはEPAほど強くVNUTを阻害しなかったため、このような研究報告はVNUTの重要性を強く支持しているとしている。
また、プリン作動性化学伝達はがん、アルツハイマー病、うつ病、潰瘍性大腸炎、肝炎などのさまざまな難治性疾患の発症に関与している。そのため、EPAやその代謝物はVNUTを標的にこれら疾患にも有効であると考えられるという。さらに、新しいVNUT阻害剤の開発は生活習慣病に対する全く新しいタイプのトランスポーター創薬につながると期待される、と研究グループは述べている。
▼関連リンク
・岡山大学 プレスリリース




