オミクロン株は以前感染した人やワクチン接種者も感染、出現前の治療用抗体のほとんどが無効
京都大学は7月14日、新型コロナウイルスの「懸念される変異株(VOC:variant of concern)」である「オミクロン株(B.1.1.529, BA系統)」を含む全ての変異株に対して、これまで使用されてきたどの治療用抗体製剤よりも中和活性が高いナノボディ抗体を創出したと発表した。この研究は、同大大学院医学研究科の高折晃史教授、大阪大学大学院生命機能研究科の難波啓一特任教授、藤田純三特任助教(常勤)、株式会社COGNANOらの研究グループと、大阪大学感染症総合教育研究拠点/微生物病研究所、横浜市立大学、東京大学の研究グループとの共同研究によるもの。研究成果は、「Communications Biology」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
COVID-19は現在も完全な収束には至らず、これまでに世界でおよそ7億人が感染し、700万人が亡くなった。新型コロナウイルス(SARSCoV-2)は、変異を繰り返して広まり、現在主流であるオミクロン株は、それまでのVOC(アルファ株、ベータ株、ガンマ株、デルタ株)と比べ、スパイクタンパクの変異箇所が圧倒的に多く、以前感染した人やワクチン接種者にも感染する。また、オミクロン株による新型コロナウイルス感染症には、その出現前に開発された治療用抗体のほとんどが効かなくなることが明らかになっている。
ヒト抗体の10分の1サイズ、スパイクタンパク質の深い溝に入り込むことが可能
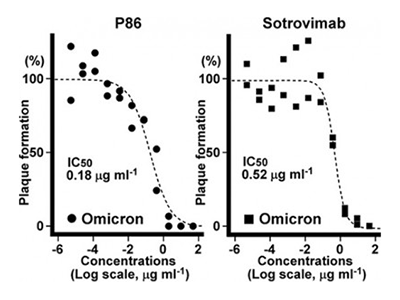
研究グループは今回、免疫したアルパカ遺伝子から最適な創薬候補をコンピュータで選択する独自技術をもとに、オミクロン株を含む全ての変異株に対して、これまで使用されてきたどの治療用抗体製剤よりも中和活性が高い、ナノボディ抗体の樹立に成功した。このアルパカ抗体は、ヒト抗体の10分の1の大きさで、ヒト抗体が到達できないスパイクタンパク質の深い溝に入り込むことができるという。
実際に、クライオ電子顕微鏡を用いた立体構造解析から、これらのナノボディ抗体が、新型コロナウイルスの表面に存在するスパイクタンパク質の深い溝をエピトープにしていることが示された。このエピトープはヒト抗体が到達できない部分であり、ウイルスの変異がほとんど見られない領域だという。
下水など環境中のウイルスの濃縮やモニタリングにも利用可能
さらに、同抗体は環境耐性が高く、全ての新型コロナウイルス変異株を検出可能。そのため、下水など、環境中のウイルスの濃縮やモニタリングにも利用することができるとしている。
COVID-19治療薬の開発に留まらず、新たな感染症治療への対応目指す
ワクチンで誘導される中和抗体や、これまでに開発された治療用抗体は、新型コロナウイルス上のスパイクタンパク質の表面に結合して感染を抑えるものが多い。しかし、より小型のナノボディ抗体は、スパイクタンパク質の表面よりも奥まった深い溝に結合できる。この深い溝には、ヒト抗体は大きすぎて入り込むことができず、宿主による抗体免疫系の選択圧がかからないため、新型コロナウイルスのほぼ全ての変異株において、変異の見られない共通の構造をしているという。
これらの知見は、大阪大学大学院生命機能研究科 難波啓一特任教授、大阪大学大学院薬学研究科 井上豪教授、大阪大学感染症総合教育研究拠点 松浦善治拠点長・特任教授(常勤)/微生物病研究所兼任の研究グループが、日本電子株式会社(JEOL)との共同研究において得たもの。また、このような稀少な有用抗体について計算科学を用いて探索する方法は、COGNANO社が世界で初めて開発した。
ナノボディ抗体は遺伝子工学による改変がしやすく、ヒト抗体よりも数千倍安価に生産できる。京都大学医学研究科高折晃史教授の研究グループは、同研究で得られた知見に基づき、より中和活性の高い改変ナノボディ抗体を作成し、臨床応用を目指している。
また、現在、京都大学、大阪大学、COGNANO社では、さまざまな感染症について、ウイルス学的な解析や、中和抗体やナノボディ抗体の構造解析についての研究に取り組んでおり、新型コロナウイルスのみならず、エイズウイルス(HIV)、ネコエイズウイルス、サル痘、その他、がん免疫を明らかにするための研究を推進している。
「ナノボディ技術を使用することで、従来のヒト抗体では成し得なかった広い中和活性をもつ抗体を開発し、そのエピトープを同定した。今後、新たなCOVID-19治療薬の開発につなげると同時に、本技術を新たな感染症治療に対応可能なパイプラインにしたい」と、研究グループは述べている。
▼関連リンク
・京都大学 最新の研究成果を知る




